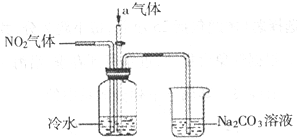
题目内容
下列反应属于离子反应的是( )
| A、锌片放入稀H2SO4中 |
| B、H2和O2反应生成水 |
| C、KMnO4加热分解制O2 |
| D、用H2还原灼热的CuO |
考点:离子方程式的书写,离子共存问题
专题:离子反应专题
分析:有离子参加的反应,为离子反应,以此来解答.
解答:
解:B、C、D中的反应均没有离子参加,均为非离子反应,只有选项A中在溶液中进行,氢离子参加反应,属于离子反应,
故选A.
故选A.
点评:本题考查离子反应,为高频考点,把握反应的特点及离子反应的判断为解答的关键,注意分析反应是否有离子参加,题目较简单.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A、0.1mol/LNaHSO4溶液中:K+ NH4+ HCO3- NO3- |
| B、与铝反应产生氢气的溶液中:Na+ NH4+ SO42- CH3COO- |
| C、由水电离产生的C(H+)=10-13mol/L的溶液中:Na+ NO3- SO42- CO32- |
| D、NaNO3溶液中:Fe2+ H+ Cl- I- |
难溶电解质的离子积常数能很好地反映电解质的溶解程度,下表是五种银盐的溶度积常数Ksp(25℃),下列说法不正确的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A、25℃时五种银盐的饱和溶液中,c(Ag+)最大的是Ag2SO4溶液 |
| B、25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同 |
| C、在氯化银的悬浊液中加入Na2S溶液可以生成黑色的Ag2S |
| D、AgBr沉淀可以转化成AgI沉淀,而 AgI沉淀在一定条件下也可以转化成AgBr沉淀 |
下列离子方程式中正确的是( )
| A、向Ca(OH)2溶液中滴入少量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| B、向H2SO4溶液中滴入少量Ba(OH)2溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、向NaOH溶液中通入足量的CO2:CO2+OH-═HCO3- |
| D、向Fe2(SO4)3溶液中滴入足量的氨水:Fe3++3OH-═Fe(OH)3↓ |
下列图示与对应的叙述相符的是( )
A、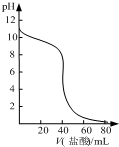 如图表示盐酸滴加到0.1mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B、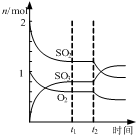 如图表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
C、 如图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
D、 如图表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
某无色溶液中加入氯化钡后有白色沉淀,再加稀硝酸沉淀不消失,则该溶液中( )
| A、一定含有SO42- |
| B、一定含有Ag+ |
| C、可能含有SO42-或Ag+ |
| D、一定含有Ag+、SO42- |