题目内容
1.肼(N2H4)可以用如下方法制备:CO(NH2)2+ClO-+OH--N2H4+Cl-+CO32-+H2O[CO(NH2)2中N为-3价],下列说法不正确的是( )| A. | N2H4是氧化产物 | |
| B. | 配平后,OH-的化学计量数是2 | |
| C. | 生成3.2g N2H4 转移0.1mol 电子 | |
| D. | 氧化剂与还原剂物质的量之比为1:1 |
分析 该反应中,N元素化合价由-3价变为-2价,Cl元素化合价由+1价变为-1价,转移电子数为2,所以方程式为CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O,以此来解答.
解答 解:该反应中,N元素化合价由-3价变为-2价,Cl元素化合价由+1价变为-1价,转移电子数为2,所以方程式为CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O,
A.N元素化合价由-3价变为-2价,所以尿素是还原剂失去电子被氧化,N2H4是氧化产物,故A正确;
B.由配平后的离子反应可知,OH-的化学计量数是2,故B正确;
C.3.2g肼的物质的量是0.1mol,生成3.2 g N2H4转移电子物质的量=0.1 mol×[1-(-1)]=0.2mol,故C错误;
D.氧化剂为ClO-,还原剂为CO(NH2)2,由反应可知,氧化剂与还原剂物质的量之比为1:1,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、电子转移计算等为解答的关键,侧重分析与应用能力的考查,注意基本概念及应用,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
19.下列说法中正确的是( )
| A. | 物质的量就是物质的质量 | |
| B. | 阿伏加德罗常数就是6.02×1023 | |
| C. | 1mol某物质溶于水一定得阿伏加德罗常数个溶质分子 | |
| D. | 98gH2SO4的物质的量与98gH3PO4的物质的量相等 |
6.丁醇(C4H10O)与乙二酸(HOOC-COOH)在一定条件下反应,生成的二元酯有( )
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 16种 |
10.LED产品的使用为城市增添色彩.下图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
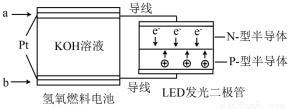

| A. | P一型半导体连接的是电池负极 | |
| B. | b 处通入O2为电池正极,发生了还原反应 | |
| C. | 通入O2的电极发生反应:O2+4e-+4H+=2H2O | |
| D. | 该装置只涉及两种形式的能量转换 |
11.一定条件下,可逆反应N2+3H2═2NH3(放热反应) 达到平衡后,只改变一个条件,下列叙述错误的是( )
| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |