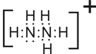题目内容
8.实验室现有一瓶2%氢氧化钠溶液(ρ=1.22g/mL).(1)该氢氧化钠溶液的物质的量浓度为0.61 mol/L
(2)由于实验需要,现还需该浓度氢氧化钠溶液230mL,需要临时配制.
①应选择250mL的容量瓶,容量瓶使用时第一步操作是检漏
②需要的玻璃仪器除了容量瓶、量筒外,还有烧杯 玻璃棒 胶头滴管
③用托盘天平称取6.1g NaOH
④经过测定,某同学配制的氢氧化钠浓度偏高,则可能的原因是CE
A.容量瓶中残存少量蒸馏水
B.称取NaOH固体时,直接在纸片上称取
C.溶解的NaOH溶液未冷却到室温,就转移到容量瓶中并定容
D.洗涤烧杯内壁后将洗涤液弃去
E.定容时,俯视容量瓶刻度线
F.定容、摇匀后发现溶液的凹液面低于刻度线
(3)取该氢氧化钠溶液20mL,加入0.5mol/L硫酸溶液10mL,然后把混合溶液稀释至100mL,则稀释后的溶液中OH-的浓度为0.022 mol/L.
分析 (1)依据C=$\frac{1000ρω}{M}$计算2%氢氧化钠溶液(ρ=1.22g/mL)的物质的量浓度;
(2)①依据配制溶液体积选择容量瓶规格结合容量瓶构造及使用方法解答;
②依据配制一定物质的量浓度的溶液步骤选择需要仪器;
③依据m=CVM;$\frac{n}{V}$
④分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)计算氢氧化钠、硫酸中氢离子的物质的量,依据方程式:OH-+H+=H2O,计算剩余氢氧化钠的物质的量,依据C=$\frac{n}{V}$计算氢氧根离子浓度.
解答 解:(1)2%氢氧化钠溶液(ρ=1.22g/mL)的物质的量浓度C=$\frac{1000×1.22×2%}{40}$=0.61mol/L;
故答案为:0.61 mol/L;
(2)①需该浓度氢氧化钠溶液230mL,应选择250mL容量瓶;容量瓶带有瓶塞,使用前应检查是否漏水;
故答为:250; 检漏;
②配制一定物质的量浓度的溶液步骤,用到的玻璃仪器有:烧杯、玻璃棒、量筒、容量瓶、胶头滴管,还缺少的仪器:烧杯 玻璃棒 胶头滴管;
故答案为:烧杯 玻璃棒 胶头滴管;
③配制250mL0.61mol/L氢氧化钠溶液,需要溶质的质量m=0.61mol/L×40g/mol×0.25L=6.1g;
故答案为:6.1;
④A.容量瓶中残存少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故不选;
B.称取NaOH固体时,直接在纸片上称取,导致溶质部分损失,溶质的物质的量偏小,溶液浓度偏低,故不选;
C.溶解的NaOH溶液未冷却到室温,就转移到容量瓶中并定容,冷却后,溶液体积偏小,溶液浓度偏高,故选;
D.洗涤烧杯内壁后将洗涤液弃去,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
E.定容时,俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故E选;
F.定容、摇匀后发现溶液的凹液面低于刻度线,属于正常操作,对溶质的物质的量和溶液体积都不会产生影响,故F不选;
故选:CE;
(3)0.61 mol/L氢氧化钠溶液20mL含有氢氧化钠物质的量为0.61mol/L×0.02L=0.0122mol,0.5mol/L硫酸溶液10mL含有氢离子物质的量为:0.5mol/L×0.01L×2=0.01mol,依据方程式:OH-+H+=H2O,则剩余的氢氧根离子的物质的量n=0.0122mol-0.01mol=0.0022mol,氢氧根离子的物质的量浓度C=$\frac{0.0022mol}{0.1L}$
=0.022mol/L;
故答案为:0.022 mol/L;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和步骤是解题关键,注意容量瓶规格选择及误差分析的方法,题目难度不大.

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 升高温度平衡向正反应方向移动 | |
| B. | 该反应在任何温度下均能自发进行 | |
| C. | 向容器中充入少量He,平衡向正反应方向移动 | |
| D. | 该反应的△S<0 |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-Q1 2H2(g)+O2(g)═2H2O(l)△H=-Q2 | |
| B. | S(g)+O2(g)═SO2(g)△H=-Q1 S(s)+O2(g)═SO2(g)△H=-Q2 | |
| C. | C(s)+O2(g)═CO2(g)△H=-Q1 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-Q2 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H=-Q1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-Q2 |
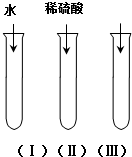 氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中.某同学想知道是稀硫酸中的H2O、H+和SO42-中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示三个实验来完成这次探究活动.
氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中.某同学想知道是稀硫酸中的H2O、H+和SO42-中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示三个实验来完成这次探究活动.