题目内容
20.N2H4(联氨又称肼)一种无色发烟的、具有腐蚀性和强还原性的无色油状液体,它是一种重要的化工试剂,在生产和生活中有着重要的作用.(1)推测有关N2H4的性质,下列说法正确的是ABCE
A.具有高度吸湿性、可燃性
B.有微弱的氨味,与甲醇,乙醇互溶,但不溶于乙醚、氯仿和苯
C.N2H4的水溶液呈弱碱性,
D.联氨的水溶液既有氧化性又有还原性,酸性溶液以氧化性为主,还原产物是N2,碱性溶液以还原性为主,氧化产物是NH4+
E.高温加热时分解为氮气、氢气和氨气.
(2)请写出N2H5+的电子式:
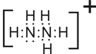
(3)在高锰酸钾催化剂存在下,尿素(CO(NH2)2)和次氯酸钠-氢氧化钠溶液反应制得联氨,它和水能按任意比例互相混溶,形成稳定的水合肼N2H4•H2O写出反应的离子方程式:
CO(NH2)2+ClO-+2OH-=N2H4•H2O+Cl-+CO32-
(4)发射卫星可用肼为燃料,用NO2作氧化剂,二者发生反应生成氮气和水蒸气.已知:
N2(g)+2O2(g)=2NO2(g) H=+67.7kJ•mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ•mol-1,
写出气态肼和NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) H=-1135.7kJ•mol-1.
(5)肼--空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,负极电极反应式是N2H4+4OH--4e-=N2↑+4H2O.
分析 (1)类比氨气的性质分析,N2H4叫联氨,又叫肼,是一种无色的高度吸湿性的可燃液体,在联氨中氮原子的孤电子对可以同H结合而显碱性,但其碱性不如氨强,联氨是一个二元弱碱,性质稳定;溶解情况,不溶于乙醚、氯仿和苯,能与水、甲醇、乙醇等混溶,与水能形成恒沸物,有吸湿性,在空气中发烟,燃烧时呈紫色火焰,液体中分子以二聚体存在,有强还原性和腐蚀性,高温加热时分解为氮气、氢气和氨气,2N2H4=2NH3↑+N2↑+H2↑,N2H4在空气中燃烧或与过氧化氢H2O2反应时,都能放出大量的热,因此可用作火箭燃料,做火箭的推进剂,有强还原性和腐蚀性;
(2)N2H5+的内部氮原子和氢原子之间存在极性共价键,根据电子式的书写知识来回答;
(3)在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨,反应还生成碳酸钠、氯化钠与水;
(4)依据盖斯定律计算,将方程式2×②-①得到气态肼和NO2反应的热化学方程式;
(5)肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,正极上氧气得电子和水反应生成氢氧根离子,据此分析解答.
解答 解:(1)A.具有高度吸湿性,在空气中发烟,燃烧时呈紫色火焰,故A正确;
B.不溶于乙醚、氯仿和苯,能与水、甲醇、乙醇等混溶,与水能形成恒沸物,故B正确;
C.N2H4的水溶液中氮原子的孤电子对可以同H+结合促进水的电离溶液显碱性,但其碱性不如氨强,故C正确;
D.液体中分子以二聚体存在,有强还原性和腐蚀性,无氧化性,故D错误;
E.高温加热时分解为氮气、氢气和氨气,2N2H4$\frac{\underline{\;高温\;}}{\;}$2NH3↑+N2↑+H2↑,故E正确;
故答案为:ABCE;
(2)N2H5+的内部氮原子和氢原子之间存在极性共价键,联氨分子中氮原子上的一个孤对电子结合氢离子形成阳离子N2H5+,电子式为: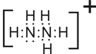 ,
,
故答案为: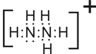 ;
;
(3)在高锰酸钾催化剂存在下,尿素(CO(NH2)2)和次氯酸钠-氢氧化钠溶液反应制得联氨,它和水能按任意比例互相混溶,形成稳定的水合肼N2H4•H2O,反应还生成碳酸钠、氯化钠,反应离子方程式为:CO(NH2)2+ClO-+2OH-=N2H4•H2O+Cl-+CO32-,
故答案为:CO(NH2)2+ClO-+2OH-=N2H4•H2O+Cl-+CO32-;
(4)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
将方程式2×②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2(-534KJ•mol-1)-(+67.7KJ•mol-1)=-1135.7kJ•mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1;
(5)肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,电极反应式为N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:N2H4+4OH--4e-=N2↑+4H2O.
点评 本题考查联氨结构和性质,热化学方程式书写和盖斯定律的应用,电极反应式的书写,注意要结合电解质溶液酸碱性书写电极反应式,联氨性质的推断需要结合知识积累和氨气结构、联氨结构及其题干信息理解判断,题目难度中等.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案①焦炭 ②烧碱 ③氧气 ④氢氟酸 ⑤硝酸 ⑥氢氧化钾 ⑦氧化钙.
| A. | ③⑤ | B. | ⑤⑦ | C. | ①④⑤ | D. | ②⑥⑦ |
| A. | CaCl2、NaOH、HCl、HD四种物质都属于化合物 | |
| B. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| C. | 溶液,浊液,胶体都属于混合物 | |
| D. | CO2、CO等非金属氧化物均属于酸性氧化物 |
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”);
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏高”、“偏低”或“无影响”);
③滴定时边滴边摇动锥形瓶,眼睛应观察B;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变为粉红(或浅红)色;
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
(C6H10O5)n$\stackrel{①}{→}$葡萄糖→乙醇$→_{②}^{+乙酸}$乙酸乙酯.
| A. | (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 | |
| B. | 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸 | |
| C. | 可以利用银镜反应证明反应①的最终产物为葡萄糖 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 | 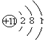 | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
(3)甲与乙两元素的单质反应生成物的电子式为
 .
.(4)甲单质与丙的氢化物反应的化学方程式为2Na+2H2O═2NaOH+H2↑.