题目内容
4.下列仪器:①天平;②容量瓶;③蒸馏烧瓶;④漏斗;⑤分液漏斗;⑥试管,用于分离物质的是( )| A. | ①③④ | B. | ①②⑥ | C. | ③④⑤ | D. | ③④⑥ |
分析 常见的混合物分离提纯方法有:过滤、蒸发、蒸馏、萃取、分液等,结合实验中的仪器来解答.
解答 解:①天平用于称量,不用于分离提纯;
②容量瓶用于配制溶液,不能分离提纯;
③蒸馏烧瓶用于沸点不同的互溶混合物分离;
④漏斗用于过滤分离混合物;
⑤分液漏斗用于分离分层的液体混合物;
⑥试管一般作反应容器,不能分离混合物,
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握分离提纯原理及仪器为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
7.与17gNH3所含的原子数相等的CO是( )
| A. | 1mol CO | B. | 56 kgCO | ||
| C. | 1.204×1023个CO分子 | D. | 2 molCO |
8.实验室常利用Cu(NO3)•3H2O和Na2CO3反应制备碱式碳酸铜2CuCO3•Cu(OH)2,下列做法中,不正确的是( )
| A. | 称取Cu(NO3)•3H2O于烧杯中,加入适量蒸馏水使其溶解得蓝色澄清溶液 | |
| B. | 把Na2CO3白色粉末加入Cu(NO3)•3H2O溶液中,同时加热促进反应 | |
| C. | 搅拌反应体系一段时间后析出大量绿色沉淀 | |
| D. | 将反应混合物过滤得绿色固体产品,用蒸馏水洗三次,烘干既得产品 |
12.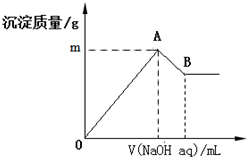 在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )
在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )
 在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )
在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )| A. | a的取值范围是0<a<$\frac{1}{15}$ | |
| B. | 图中m的取值范围5.2~5.8 | |
| C. | A、B两点横坐标的数值均随x变化而变化 | |
| D. | 若B点横坐标数值为120,则a=0.04 |
19.L、M、Q、R、T是短周期元素,如表是这些元素的原子半径及主要化合价信息:
请回答下列问题:
(1)上述元素中最活泼的金属元素是Mg(填元素符号,下同),最活泼的非金属元素是O.
(2)L、M、R、T的简单离子半径由大到小的顺序为S2->O2->Mg2+>Al3+(填离子符号).
(3)上述元素的最高价氧化物对应的水化物中碱性最强的是Mg(OH)2(填化学式,下同),具有两性的是Al(OH)3.
(4)上述元素形成的气态氢化物中最稳定的是H2O(填化学式).
(5)L、M的单质在稀硫酸中用导线连接可形成原电池,其正极材料是Mg.
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
(1)上述元素中最活泼的金属元素是Mg(填元素符号,下同),最活泼的非金属元素是O.
(2)L、M、R、T的简单离子半径由大到小的顺序为S2->O2->Mg2+>Al3+(填离子符号).
(3)上述元素的最高价氧化物对应的水化物中碱性最强的是Mg(OH)2(填化学式,下同),具有两性的是Al(OH)3.
(4)上述元素形成的气态氢化物中最稳定的是H2O(填化学式).
(5)L、M的单质在稀硫酸中用导线连接可形成原电池,其正极材料是Mg.
9.现有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L,要使Mg2+与Al3+完全分离,至少需加4mol/L的NaOH溶液的体积为( )
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
16.正在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O.以下叙述正确的是( )
| A. | 硫酸盐都易溶于水 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品-→粉碎-→加水溶解-→过滤-→向滤液中滴加KSCN溶液 | |
| C. | 分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3:2:3 | |
| D. | 明矾含有结晶水,是混合物 |
13.为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如表:
注:经检验黑色固体为Ag
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag )生成,加入KSCN 溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a 中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负 极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如表实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3 ) 3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+ 浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如表:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3 溶液加入到1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN 溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag )生成,加入KSCN 溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.

b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a 中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负 极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如表实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+ 浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
14.下列叙述错误的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| C. | 乙酸和油脂都能与氢氧化钠溶液反应 | |
| D. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |