题目内容
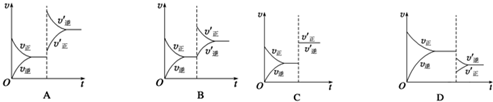
7. 如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )
如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )| A. | a点和b点的Ksp:a<b | |
| B. | 向溶液a中加入CaO并恢复原温度时,溶液的pH不变 | |
| C. | b点时,Ca(OH)2在水中和在NaOH溶液中的溶解度:s(H2O)>s(NaOH) | |
| D. | 溶解速率:b点>a点 |
分析 A.氢氧化钙溶解度随着温度升高而降低;
B.a点溶液为氢氧化钙的饱和溶液;
C.Ca(OH)2(S)?Ca2+(aq)+2OH-(aq),氢氧化钠电离产生氢氧根离子,依据浓度对溶解平衡移动的影响解答;
D.温度越高,分子热运动加快,因此,升高温度,可令固体的分子热运动回快,扩散进入溶剂中,溶解速度变快.
解答 解:A.氢氧化钙溶解度随着温度升高而降低,所以a点和b点的Ksp:a>b,故A错误;
B.向溶液a中加入CaO并恢复原温度时,得到溶液仍然为饱和溶液,相同温度下,溶解度相同,溶液浓度相同,溶液的pH值相同,故B错误;
C.Ca(OH)2(S)?Ca2+(aq)+2OH-(aq),在氢氧化钠溶液中,氢氧化钠电离产生氢氧根离子,使溶解平衡逆向移动,氢氧化钙溶解度减小,所以b点时,Ca(OH)2在水中和在NaOH溶液中的溶解度:s(H2O)<s(NaOH),故C错误;
D.温度越高,固体溶解速率越大,所以溶解速率:b点>a点,故D正确;
故选:ABC.
点评 本题考查了物质的溶解平衡、溶解度及影响因素,明确氢氧化钙溶解度随着温度升高而降低的性质是解题关键,题目难度中等.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
15.下列物质的转化在给定条件下能实现的是( )
| A. | Al(OH)3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe | |
| C. | Al$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{△}{→}$NaAlO2(s) | |
| D. | Cu(OH)2 $\stackrel{HNO_{3}(ap)}{→}$Cu(NO3)2(aq)$\stackrel{蒸发}{→}$Cu(NO3)2晶体 |
1.进行中和滴定实验使用的下列仪器,用蒸馏水洗涤后立即使用,不会引起实验误差的是( )
| A. | 酸式滴定管 | B. | 锥形瓶 | C. | 碱式滴定管 | D. | 以上均不正确 |
19.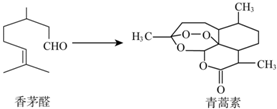 中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
 中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )| A. | 香茅醛能使Br2的CCl4溶液褪色 | B. | 青蒿素分子式为C15H22O5 | ||
| C. | 青蒿素含有和H2O2相同的过氧键 | D. | 青蒿素能与氢气发生加成反应 |
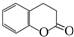 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(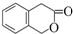 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.