题目内容
13.图是土豆电池的示意图.土豆电池工作时,下列有关说法正确的是( )
| A. | Fe用作正极 | B. | Cu片质量减少 | ||
| C. | 电子由Fe并经导线流向Cu片 | D. | 实现了电能向化学能的转化 |
分析 根据金属的活泼性知,Fe作负极,Cu作正极,负极上Fe失电子发生氧化反应,正极上发生得电子的还原反应,电子从负极沿导线流向正极,据此解答.
解答 解:A.该原电池中,Fe的活泼性比Cu强,Fe作负极,故A错误;
B.铁为负极,发生氧化反应,正极上的金属Cu不会参加电极反应,故B错误;
C.Fe作负极,铜作正极,电子从Fe沿导线流向Cu,故C正确;
D.形成原电池反应,化学能转化为电能,故D错误;
故选C.
点评 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,难度不大,明确电子的移动方向、电极的判断是解题的关键.

练习册系列答案
相关题目
3.向氯化铁溶液中加入ag铜粉,完全溶解后再加入b g铁粉,充分反应后过滤得到滤液和固体c g.下列说法正确的是( )
| A. | 若a>c,则滤液中可能含三种金属离子,且b可能小于c | |
| B. | 若a>c,则c g固体中只含一种金属,且b可能大于c | |
| C. | 若a<c,则c g固体含两种金属,且b可能与c相等 | |
| D. | 若a=c,则滤液中可能含两种金属离子,且b可能小于c |
1.在一定温度下的恒容密闭容器中,能说明化学反应X2(g)+Y2(g)?2XY(g)已达到平衡状态的是( )
| A. | 容器内的总压强不随时间变化 | B. | 正、逆反应都还在继续进行 | ||
| C. | XY气体的物质的量分数不变 | D. | X2和Y2的消耗速率相等 |
8.下列元素中,金属性最强的是( )
| A. | 锂 | B. | 钠 | C. | 镁 | D. | 铝 |
18.将11g铝、铁混合物投人280mL 4mol•L-1的稀硝酸中,金属完全溶解,生成0.28mol气体,向反应后的溶液中加人500mL3mol•L-1的Na0H溶液,并充分搅拌、过滤、洗涤、干燥后称量得到10.7g固体.下列说法正确的是( )
| A. | 混合物中铝、铁的物质的量之比1:2 | |
| B. | 混合物与稀硝酸反应后的溶液还能溶解1.28g Cu | |
| C. | 将0.28mol气体通人水中并完全被吸收时,需要消耗0.14mol氧气 | |
| D. | 10.7g固体为Al(OH)3和Fe(OH)3的混合物 |
5.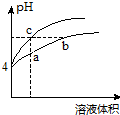 某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
 某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )| A. | a、c两点溶液的导电能力:c>a | |
| B. | a、b、c三点溶液中水的电离程度:a>b>c | |
| C. | b点溶液中:c(H+)=c(Cl-)+c(OH-) | |
| D. | 用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb=Vc |
2.下列有关Si、Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 过量的铁粉与氯气反应生成FeCl2 | |
| B. | 少量SO2通入Ca(ClO)2 溶液生成CaSO3沉淀 | |
| C. | 常温下,1 mol Fe与足量浓硝酸反应,转移2NA个电子 | |
| D. | 硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
3.可逆反应A(g)+3B(g)?2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是( )
| A. | v(A)=9.0mol/(L•min) | B. | v(B)=0.6 mol/(L•s) | C. | v(C)=0.3 mol/(L•s) | D. | v(D)=0.1 mol/(L•s) |