题目内容
25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,KW减小 |
| B、向水中加入少量固体硫酸钠,平衡不移动,KW不变 |
| C、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D、向水中加入少量固体NH4Cl,平衡正向移动,c(H+)降低 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.KW只受温度的影响;
B.硫酸钠为强酸强碱盐,溶液呈中性;
C.醋酸根离子结合水电离的氢离子,平衡向着正向移动;
D.NH4Cl为强酸弱碱盐,水解呈酸性.
B.硫酸钠为强酸强碱盐,溶液呈中性;
C.醋酸根离子结合水电离的氢离子,平衡向着正向移动;
D.NH4Cl为强酸弱碱盐,水解呈酸性.
解答:
解:A.向水中加入稀氨水,氨水是弱电解质,电离的氢氧根使溶液中氢氧根浓度增大,平衡逆向移动,由于温度不变,则KW不变,故A错误;
B.硫酸钠为强酸强碱盐,溶液呈中性,对水的电离平衡没有影响,平衡不移动,KW不变,故B正确;
C.向水中加入少量固体醋酸钠,醋酸根离子水解,促进了水的电离,平衡向着正向移动,c(H+)降低,故C错误;
D.NH4Cl为强酸弱碱盐,水解呈酸性,c(H+)增大,故D错误.
故选B.
B.硫酸钠为强酸强碱盐,溶液呈中性,对水的电离平衡没有影响,平衡不移动,KW不变,故B正确;
C.向水中加入少量固体醋酸钠,醋酸根离子水解,促进了水的电离,平衡向着正向移动,c(H+)降低,故C错误;
D.NH4Cl为强酸弱碱盐,水解呈酸性,c(H+)增大,故D错误.
故选B.
点评:本题考查了水的电离平衡及其影响因素,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意明确水的电离为吸热反应、温度升高水的电离程度增大、水的离子积增大;可以根据勒夏特列原理判断影响水的电离情况.

练习册系列答案
相关题目
关于食物的酸碱性,下列说法正确的是( )
| A、食物溶于水后的溶液中pH<7,则为酸性食物 |
| B、由C、N、S、P等元素组成的蛋白质是酸性食物 |
| C、蔬菜、水果多含钾、钠、钙、镁等盐类及果酸,习惯称为酸性食物 |
| D、柠檬酸是酸性食物 |
下列有机物的系统命名中正确的是( )
| A、3-甲基-4-乙基戊烷 |
| B、1,5-二甲苯 |
| C、2-乙基-1-庚烯 |
| D、3-甲基-2-辛炔 |
在一个可以加热的密闭容器中,加入Na2O2和NaHCO3各0.5mol,将容器加热至400℃,待充分反应后排出气体,则容器中剩余的固体是( )
| A、Na2CO3 |
| B、Na2CO3和Na2O2 |
| C、NaOH |
| D、Na2CO3和NaOH |
下列关于合金的叙述不正确的是( )
| A、合金硬度比它的各成分金属高 |
| B、合金熔点比它的各成分金属的高 |
| C、合金具有优良的机械性能 |
| D、钢是用量最大、用途最广的合金 |
关于如图装置的叙述,正确的是( )


| A、铝是负极,铝片上析出无色气体 |
| B、石墨是阳极,石墨棒上析出黄绿色气体 |
| C、溶液中两电极间产生白色沉淀 |
| D、溶液中先产生白色沉淀,最后沉淀溶解 |
化学与环境密切相关,下列说法正确的是( )
| A、CO2属于大气污染物 |
| B、酸雨是pH小于7的雨水 |
| C、CO2、NO2或SO2都会导致酸雨的形成 |
| D、大雾是一种胶体,能发生丁达尔效应 |
下列有关化学用语表示正确的是( )
| A、中子数为8的N原子:78N |
B、离子结构示意图: 只能表示35Cl- 只能表示35Cl- |
| C、碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
| D、作为相对原子质量标准的碳原子:614C |
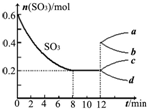 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示: