题目内容
中国古代四大发明之一--黑火药,它的爆炸反应为:2KNO3+3C+S→A+N2↑+3CO2↑(已配平)
①除S外,其余元素的电负性从大到小依次为 .
②在生成物中,A的晶体类型为 ;含极性共价键的分子中中心原子的杂化轨道类型为 .
③已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为 .
①除S外,其余元素的电负性从大到小依次为
②在生成物中,A的晶体类型为
③已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为
考点:元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:①非金属性越强,则电负性越强;
②利用质量守恒定律来判断出A的化学式,然后判断晶体类型;含极性共价键的分子为CO2,根据价层电子对数判断;
③等电子体的结构相同,根据氮气的结构分析.
②利用质量守恒定律来判断出A的化学式,然后判断晶体类型;含极性共价键的分子为CO2,根据价层电子对数判断;
③等电子体的结构相同,根据氮气的结构分析.
解答:
解:①非金属性越强,则电负性越强,非金属性:O>N>C>K,则电负性O>N>C>K;
故答案为:O>N>C>K;
②由化学方程式为S+2KNO3+3C→X+N2↑+3CO2↑,根据质量守恒定律可知,反应前后元素种类、原子个数相等,则A的化学式为K2S,属于离子晶体;含极性共价键的分子为CO2,二氧化碳的结构式为O=C=O,则含有2个价层电子对,所以C原子为sp杂化;
故答案为:离子晶体;sp;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,
故答案为:1:1.
故答案为:O>N>C>K;
②由化学方程式为S+2KNO3+3C→X+N2↑+3CO2↑,根据质量守恒定律可知,反应前后元素种类、原子个数相等,则A的化学式为K2S,属于离子晶体;含极性共价键的分子为CO2,二氧化碳的结构式为O=C=O,则含有2个价层电子对,所以C原子为sp杂化;
故答案为:离子晶体;sp;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,
故答案为:1:1.
点评:本题考查了电负性、晶体类型的判断、杂化轨道、等电子体等,难度不大,注意对基础知识的理解掌握,注意把握等电子体原理.

练习册系列答案
相关题目
已知反应:①101kPa时,C(s)+
O2(g)=CO(g);△H1=-110.5kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H2=-57.3kJ/mol,下列结论正确的是( )
| 1 |
| 2 |
| A、若碳的燃烧热用△H3来表示,则△H3<△H1 |
| B、若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C、稀硫酸与稀NaOH溶液反应的中和热△H=-57.3kJ/mol |
| D、浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
 完成以下三个小题
完成以下三个小题 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
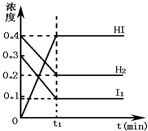 可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答:
可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答: