题目内容
18.下列选用的相关仪器符合实验要求的是( )| A. |  存放浓硝酸 | B. |  分离水和乙酸乙酯 | ||
| C. |  准确量取9.50mL液体 | D. |  存放氯化钙固体 |
分析 A.依据浓硝酸具有强的氧化性,见光分解的性质解答;
B.分液漏斗用来分离互不相溶的液体;
C.依据量筒的精确度解答;
D.固体药品用广口瓶盛放,液体用细口瓶盛放;
解答 解:A.浓硝酸具有强的氧化性,见光分解,应保存在棕色瓶,橡胶塞易钡氧化而老化,不能用橡胶塞,故A错误;
B.水与乙酸乙酯互不相溶,二者放在一起分层,可以用分液漏斗分离,故B正确;
C.量筒精确度为0.1mL,不能用来量取9.50mL液体,故C错误;
D.氯化钠为固体,应采用广口瓶盛放,故D错误;
故选:B.
点评 本题考查了实验仪器的使用方法,涉及药品的存放、计量仪器的精确值等,熟悉相关药品的性质是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列过程中,把化学能转化为热能的是( )
| A. | 风力发电 | B. | 干电池产生电流 | C. | 木炭燃烧 | D. | 用电取暖器取暖 |
13.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
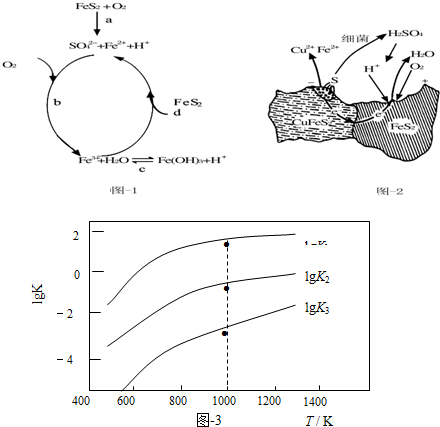
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图-2
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图-3.
①上述反应中,△H1>0(选填:“>”或“<”).
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.

(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图-2
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图-3.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.
1.甲、乙两同学在学习了铁的性质后.分别用如下装置进行“Fe粉与水蒸气的反应产物”的实验.
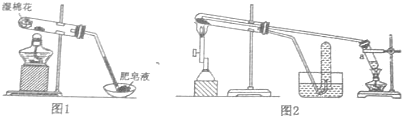
(1)甲同学用图1所示装置进行实验,写出铁粉与H2O蒸气反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,简述证明实验中有氢气产生的实验操作及现象:有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸;
(2)乙同学用图2所示装置进行实验.试管a的作用是提供水蒸气;为探究实验结柬后试管内固体物质的成分,乙同学进行了下列实验:
简述步骤Ⅰ中发生反应的离子方程式:Fe3O4+8H+═Fe2++2Fe3++4H2O,Fe+2H+═Fe2++H2↑,简述步骤Ⅱ中“溶液没有出现红色”的原因溶液中三价铁离子可能被过量铁还原为亚铁离子(2Fe3++Fe=3Fe2+).

(1)甲同学用图1所示装置进行实验,写出铁粉与H2O蒸气反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,简述证明实验中有氢气产生的实验操作及现象:有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸;
(2)乙同学用图2所示装置进行实验.试管a的作用是提供水蒸气;为探究实验结柬后试管内固体物质的成分,乙同学进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到的黑色固体X,取出少量放人另一试管中,加人少量盐酸,微热 | 黑色粉末逐渐溶解,产生少量气泡 |
| Ⅱ | 向上述实验得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液未出现红色 |
2.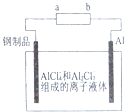 已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
 已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )| A. | a电极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH- | |
| B. | 银锌电池的电解质溶液可用稀硫酸 | |
| C. | 银锌电池放电时,负极附近溶液的pH增大 | |
| D. | Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4- |
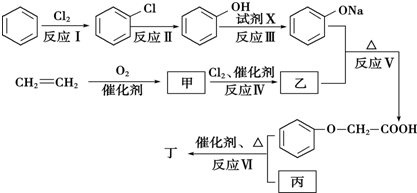
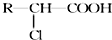
 .
.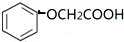 )有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有
)有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有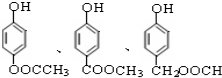 (其中两种)(任写两种即可).
(其中两种)(任写两种即可).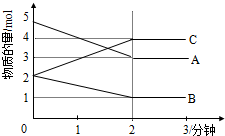 某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色).
某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色).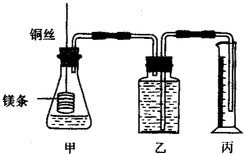 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下: