题目内容
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A、生成40.0LN2(标准状况) |
| B、有0.250molKNO3被氧化 |
| C、转移电子的物质的量为1.25mol |
| D、被氧化的N原子的物质的量为3.5mol |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:该反应中N元素化合价由-
价、+5价变为0价,所以氧化产物和还原产物都是氮气,假设有16mol氮气生成,氧化产物是15mol、还原产物是1mol,则氧化产物比还原产物多14mol,若氧化产物比还原产物多1.75mol,则参加反应的n(KNO3)=
×2=0.25mol,再结合各个物理量之间的关系式计算.
| 1 |
| 3 |
| 1.75mol |
| 14mol |
解答:
解:该反应中N元素化合价由-
价、+5价变为0价,所以氧化产物和还原产物都是氮气,假设有16mol氮气生成,氧化产物是15mol、还原产物是1mol,则氧化产物比还原产物多14mol,若氧化产物比还原产物多1.75mol,则参加反应的n(KNO3)=
×2=0.25mol,
A.生成氮气的体积=
×16×22.4L/mol=44.8 L N2,故A错误;
B.硝酸钾得电子作氧化剂而被还原,故B错误;
C.转移电子的物质的量=3n(KNO3)=5×0.25mol=1.25mol,故C正确;
D.被氧化的N原子的物质的量=
×10×3=3.75 mol,故D错误;
故选C.
| 1 |
| 3 |
| 1.75mol |
| 14mol |
A.生成氮气的体积=
| 1.75mol |
| 14mol |
B.硝酸钾得电子作氧化剂而被还原,故B错误;
C.转移电子的物质的量=3n(KNO3)=5×0.25mol=1.25mol,故C正确;
D.被氧化的N原子的物质的量=
| 1.75mol |
| 14mol |
故选C.
点评:本题考查了氧化还原反应的计算,为高频考点,根据元素化合价变化结合各个物理量之间的关系式分析解答,注意氮化钠中N元素化合价,该反应的氧化产物和还原产物都是氮气,知道氧化产物和还原产物的物质的量之比,为易错点.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
下列数量的各物质所含原子个数由大到小顺序排列的是( )
①0.5mol氨气 ②1g氢气 ③4℃时9mL水④0.2mol磷酸钠.
①0.5mol氨气 ②1g氢气 ③4℃时9mL水④0.2mol磷酸钠.
| A、④③②① | B、①④③② |
| C、②③④① | D、①④②③ |
下列实验装置选择正确,能达到目的是( )
A、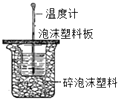 测定酸碱反应中和热 |
B、 测定反应速率 |
C、 实现化学能转换为电能 |
D、 测定食醋浓度 |

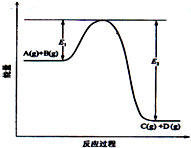 反应A(g)+B(g) 错误!未找到引用源C(g)+D(g)过程中的能量变化如图所示,请回答下列问题:
反应A(g)+B(g) 错误!未找到引用源C(g)+D(g)过程中的能量变化如图所示,请回答下列问题:
 将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.
将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.