题目内容
15.将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,则通入甲烷的一极,其电极反应为:CH4+10OH--8e-=CO32-+7H2O..分析 甲烷、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水.
解答 解:甲烷、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,氧气所在电极为正极,负极上电极反应式为CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O.
点评 本题考查了化学电源新型电池,根据得失电子确定正负极上通入的气体,难点是电极反应式的书写,注意碱性条件下甲烷失电子不能生成氢离子,要生成碳酸根离子,为易错点.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
6.仪器名称为“分液漏斗”的是( )
| A. |  | B. |  | C. |  | D. |  |
20.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )
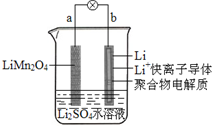

| A. | a为电池的正极 | B. | 放电时,电子由b极流向a极 | ||
| C. | 充电时,a极发生还原反应 | D. | 放电时,溶液中的Li+从b向a迁移 |
7.下列气体不能用排空气法收集的是( )
| A. | SO2 | B. | NH3 | C. | NO | D. | NO2 |
4.下列比较关系与排列顺序错误的是( )
| A. | 酸性 H2SiO3<H3PO4<H2SO4 | B. | 碱性 Ca(OH)2>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性SiH4>NH3>H2O>HF | D. | 原子半径大小:Na>S>O |
5.下列电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键. 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题: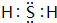 .
.