题目内容
5.下列电子式书写正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A.氯化钾为离子化合物,电子式中需要标出阴阳离子所带电荷;
B.二氧化碳中存在两对碳氧共用电子对,碳原子最外层为8个电子;
C.溴化镁为离子化合物,电子式中需要标出阴阳离子所带电荷;
D.氯化氢为共价化合物,分子中存在一个氢氯共用电子对,氯原子最外层一个为8个电子.
解答 解:A.氯化钾属于离子化合物,电子式中钾离子形成离子符号形式,氯离子需要标出最外层电子,氯化钾的电子式为 ,故A正确;
,故A正确;
B.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ,故B错误;
,故B错误;
C.溴化镁为离子化合物,溴离子为-1价,镁离子为+2价,电子式为: ,故C错误;
,故C错误;
D.氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为 ,故D错误;
,故D错误;
故选A.
点评 本题考查了电子式的判断,该题基础性强,题目难度不大,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列说法正确的是( )
| A. | 20Ne和22Ne互为同位素 | B. | 液氯和氯水是同一种物质 | ||
| C. | 金刚石和石墨互为同分异构体 | D. | 碘单质和碘蒸气互为同素异形体 |
13. 最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
 最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4与N2互称为同位素 | |
| C. | N4化学性质比N2稳定 | |
| D. | 1molN4沸气体转变为N2将放出882kJ热量 |
20. 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )| A. | N4与N2互称为同位素 | |
| B. | N4属于一种新型的化合物 | |
| C. | N4化学性质比N2稳定 | |
| D. | 1mol N4气体转化为N2时要放出882kJ能量 |
10.清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图.下列说法正确的是( )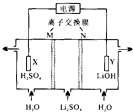

| A. | N为阳离子交换膜 | |
| B. | X电极连接电源负极 | |
| C. | 制备2.4 g LiOH产生2.24 L H2(标况) | |
| D. | Y电极反应式为O2+2H2O+4e一=40H- |
17.高氯酸铜[Cu(ClO4)2•6H2O]易溶于水,120℃开始分解,常用于生产电极和作催化剂等.可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O═Cu2(OH)2CO3↓+CO2↑+4NaCl; Cu2(OH)2CO3+4HClO4+9H2O═2Cu(ClO4)2•6H2O+CO2↑.HClO4是易挥发的发烟液体,温度高于130℃易爆炸.下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1mol•L-1):
(1)将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液.静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀.
①把反应物研细的目的是增大反应物之间的接触面积,使反应速率增大.
②检验沉淀是否洗涤干净,应选用试剂是HNO3和AgNO3溶液.
(2)向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾.
①大量的白雾的成分是HClO4(填化学式).
②适度加热但温度不能过高的原因是防止HClO4、Cu(ClO4)2分解.
(3)某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体.请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):①将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;加入适量双氧水溶液并充分混合,再加入适量氨水调节溶液pH至3.2~4.7,②过滤;③将滤液加热浓缩,冷却结晶,过滤、(冰水)洗涤,干燥,得到CuCl2•2H2O晶体;④将CuCl2•2H2O晶体在HCl气氛中加热至质量不再变化为止,得到无水氯化铜固体.
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
①把反应物研细的目的是增大反应物之间的接触面积,使反应速率增大.
②检验沉淀是否洗涤干净,应选用试剂是HNO3和AgNO3溶液.
(2)向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾.
①大量的白雾的成分是HClO4(填化学式).
②适度加热但温度不能过高的原因是防止HClO4、Cu(ClO4)2分解.
(3)某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体.请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):①将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;加入适量双氧水溶液并充分混合,再加入适量氨水调节溶液pH至3.2~4.7,②过滤;③将滤液加热浓缩,冷却结晶,过滤、(冰水)洗涤,干燥,得到CuCl2•2H2O晶体;④将CuCl2•2H2O晶体在HCl气氛中加热至质量不再变化为止,得到无水氯化铜固体.
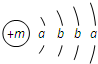 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.