题目内容
15.在恒温恒容的容器中,发生反应:H2(g)+CO(g)?C(s)+H2O(g).初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法中不正确的是( )| A. | 反应前后气体的压强之比为4:3 | |
| B. | 反应前后气体的密度之比为l5:16 | |
| C. | H2与CO的转化率相等,均为50% | |
| D. | 若H2与CO按8:5体积比混合,则反应前后混合气体的平均相对分子质量不变 |
分析 设初始时加入H2、CO 分别为xmol、ymol,则由平均相对分子质量为15,所以$\frac{2x+28y}{x+y}$=15,解得x:y=1:1;可令设初始时加入H2、CO 都为1mol;
H2(g)+CO(g)=C(s)+H2O(g).
初起的物质的量:1mol 1mol 0 0
变化的物质的量:z z z z
平衡时物质的量:1-z 1-z z z
由题意可知:$\frac{(1-z)×2+28×(1-z)+18z}{2-z}$=16,
解得z=0.5mol,以此解答该题.
解答 解:A.根据以上分析,反应前后气体的压强之比为2:(2-0.5)=4:3,故A正确;
B.因为恒温恒容的容器中,所以反应前后气体的密度之比即为气体质量之比,所以为(2×1+28×1):(2×0.5+28×0.5+18×0.5)=5:4,故B错误;
C.根据以上分析,CO的转化率为$\frac{0.5}{1}$×100%=50%,故C正确;
D.假设体积为1L,按1:1反应时,平衡常数为$\frac{0.5}{0.5×0.5}$=2,若H2与CO按8:5体积比混合,则反应前混合气体的平均相对分子质量为$\frac{2×8+5×28}{8+5}$=12,
设H2与CO按8:5体积比混合,物质的量分别为8mol、5mol,体积仍为1L,
则 H2(g)+CO(g)=C(s)+H2O(g)
初起的物质的量:8mol 5mol 0 0
变化的物质的量:n n n n
平衡的物质的量 8-n 5-n n n
则$\frac{n}{(8-n)×(5-n)}$=2,
n=4,
则相对分子质量为$\frac{4×2+28×1+4×18}{9}$=12,
故D正确.
故选B.
点评 本题考查了化学平衡的相关判断及其计算,为高频考点,侧重考查学生的分析、计算能力,注意利用三组量法计算计算,题目难度中等.

①酒精 ②苯 ③四氯化碳 ④分液 ⑤萃取 ⑥蒸馏.
| A. | ②④ | B. | ②④⑤ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
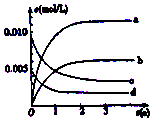 800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )
800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
| A. | a线表示NO2的变化趋势,则0~2s内v(NO2)=0.006mol/(L•s) | |
| B. | 800℃时,该反应的平衡常数K=1125L/mol | |
| C. | 能使该反应的反应速率增大,且平衡向正方向移动的措施是及时分理出NO2 | |
| D. | 已知:K300℃>K350℃,则该反应时吸热反应 |
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| B. | 使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 | |
| C. | 江河入海口常形成三角洲 | |
| D. | 肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
| A. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| B. | 石油裂解、煤的气化、葡萄糖制取酒精等过程中都包含化学变化 | |
| C. | 低碳经济就是以低能耗、低污染、低排放为基础的经济发展模式 | |
| D. | 食用植物油、麦芽糖和石油气都是纯净物 |
| A. | 锰钢 | B. | 青铜 | C. | 铝锂合金 | D. | 镧镍储氢合金 |
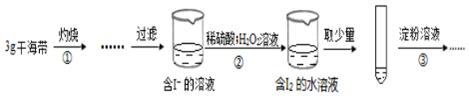
下列说法不正确的是( )
| A. | 步骤①需要将干海带放入坩埚中灼烧 | |
| B. | 步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O | |
| C. | 步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素 | |
| D. | 若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化 |
| A. | 醋酸与CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2═2 Fe3++I2+4Br- | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2+H2O↑ |