题目内容
写出下列物质在水溶液中的电离方程式:
KHCO3 ,H2CO3 .
KHCO3
考点:电离方程式的书写
专题:
分析:碳酸氢钾为强电解质,在水中完全电离生成钾离子和碳酸氢根离子;
碳酸为多元弱酸,分步电离,以第一步为主.
碳酸为多元弱酸,分步电离,以第一步为主.
解答:
解:碳酸氢钾为强电解质,在水中完全电离,电离方程式为:KHCO3=K++HCO3-,HCO3-H++CO32-,
碳酸为弱酸部分电离,电离方程式为:H2CO3 H++HCO3-,HCO3-
H++HCO3-,HCO3- H++CO32-;
H++CO32-;
故答案为:KHCO3=K++HCO3-;H2CO3?H++HCO3-,HCO3-?H++CO32-.
碳酸为弱酸部分电离,电离方程式为:H2CO3
 H++HCO3-,HCO3-
H++HCO3-,HCO3- H++CO32-;
H++CO32-;故答案为:KHCO3=K++HCO3-;H2CO3?H++HCO3-,HCO3-?H++CO32-.
点评:本题考查了电解质电离方程式的书写,明确电解质的强弱是解题关键,注意多元弱酸分步电离,以第一步为主.

练习册系列答案
相关题目
下列装置所示的实验中,能达到实验目的是( )
A、 除去Cl2中的HCl |
B、 防止地下钢管腐蚀 |
C、 分离酒精和水 |
D、 电解精炼铜 |
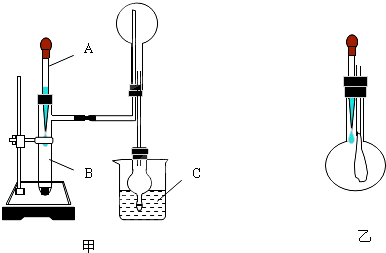
 制取氨气并完成喷泉实验(图中夹持装置均已略去).
制取氨气并完成喷泉实验(图中夹持装置均已略去).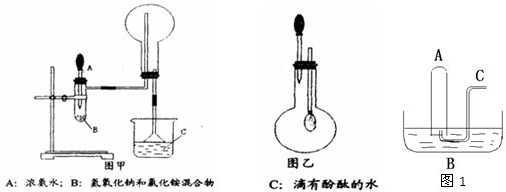

 制备化合物
制备化合物
 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )