题目内容
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是选项叙述I叙述II( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | HCl的酸性比H2CO3强 | 氯的非金属性大于碳 |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
| A、A | B、B | C、C | D、D |
考点:检验三价铁与二价铁,非金属在元素周期表中的位置及其性质递变的规律,硅和二氧化硅
专题:
分析:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.KSCN溶液和Fe3+发生反应生成络合物硫氰化铁而使溶液呈血红色;
C.碱金属的碳酸盐溶解度大于碳酸氢盐;
D.玻璃中含有二氧化硅,能和HF反应.
B.KSCN溶液和Fe3+发生反应生成络合物硫氰化铁而使溶液呈血红色;
C.碱金属的碳酸盐溶解度大于碳酸氢盐;
D.玻璃中含有二氧化硅,能和HF反应.
解答:
解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,HCl不是Cl元素的最高价氧化物的水化物,所以不能据此判断氯的非金属性大于碳,应该用HClO4和H2CO3的酸性强弱判断,故A错误;
B.KSCN溶液和Fe3+发生反应生成络合物硫氰化铁而使溶液呈血红色,该反应中Fe元素化合价不变,不体现Fe元素的氧化性,故B错误;
C.碱金属的碳酸盐溶解度大于碳酸氢盐,所以溶解度:Na2CO3>NaHCO3,故C错误;
D.玻璃中含有二氧化硅,能和HF反应生成SiF4和H2O,所以氢氟酸不能保存在玻璃瓶中,应该用塑料瓶,故D正确;
故选D.
B.KSCN溶液和Fe3+发生反应生成络合物硫氰化铁而使溶液呈血红色,该反应中Fe元素化合价不变,不体现Fe元素的氧化性,故B错误;
C.碱金属的碳酸盐溶解度大于碳酸氢盐,所以溶解度:Na2CO3>NaHCO3,故C错误;
D.玻璃中含有二氧化硅,能和HF反应生成SiF4和H2O,所以氢氟酸不能保存在玻璃瓶中,应该用塑料瓶,故D正确;
故选D.
点评:本题考查较综合,涉及药品的贮存、物质的溶解性、离子检验、非金属性强弱判断等知识点,明确物质的性质是解本题关键,知道铁离子、亚铁离子的检验方法及现象,知道金属性和非金属性强弱判断方法,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A、NaCl晶体、BaSO4 |
| B、铜、二氧化硫 |
| C、硫酸、酒精 |
| D、熔融的KNO3、硫酸溶液 |
某溶液中含有SO32-、Br-、SiO32-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的只有Na+
②有胶状沉淀物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应.
①反应前后,溶液中离子浓度基本保持不变的只有Na+
②有胶状沉淀物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应.
| A、①②③④⑤ | B、①②③④ |
| C、①③⑤ | D、②④⑤ |
在一定的温度下,可逆反应A(g)+3B(g)?2C(g)+3D(s)达到平衡的标志是( )
| A、体系中混合气体的密度保持不变 |
| B、A、B、C的浓度相等 |
| C、单位时间生成n mol A,同时分解2n mol C |
| D、A、B、C的分子数之比为1:3:2 |

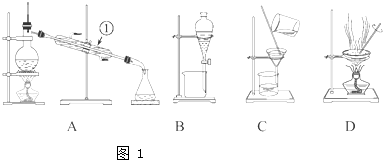 如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: