题目内容
下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A、pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | ||||
B、0.1 mol?L-1 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO
| ||||
| C、物质的量浓度相等的HF和NaF溶液等体积混合后有:c(Na+)=c(HF)+c(F-) | ||||
| D、0.1 mol?L-1 NaHS溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.一水合氨为弱碱,溶液中部分电离出氢氧根离子,则pH=3的盐酸溶液和pH=11的氨水等体积混合,氨水过量,溶液显示碱性,根据电荷守恒可知c(Cl-)<c(NH4+);
B.根据碳酸氢钠溶液中的电荷守恒判断,注意碳酸根离子带有两个单位负电荷,其系数应该为2;
C.根据HF和NaF混合液中的物料守恒判断;
D.根据硫氢化钠溶液中物料守恒判断.
B.根据碳酸氢钠溶液中的电荷守恒判断,注意碳酸根离子带有两个单位负电荷,其系数应该为2;
C.根据HF和NaF混合液中的物料守恒判断;
D.根据硫氢化钠溶液中物料守恒判断.
解答:
解:A.pH=3的盐酸溶液中氯化氢的浓度为0.001mol/L,pH=11的氨水中一水合氨浓度大于0.001mol/L,混合液显示碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(Cl-)<c(NH4+),溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A错误;
B.碳酸氢钠溶液中,根据电荷守恒可知:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B错误;
C.物质的量浓度相等的HF和NaF溶液等体积混合,根据物料守恒可知:2c(Na+)=c(HF)+c(F-),故C错误;
D.0.1 mol?L-1 NaHS溶液中,根据物料守恒可知:c(Na+)=c(S2-)+c(HS-)+c(H2S)=0.1mol/L,故D正确;
故选D.
B.碳酸氢钠溶液中,根据电荷守恒可知:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B错误;
C.物质的量浓度相等的HF和NaF溶液等体积混合,根据物料守恒可知:2c(Na+)=c(HF)+c(F-),故C错误;
D.0.1 mol?L-1 NaHS溶液中,根据物料守恒可知:c(Na+)=c(S2-)+c(HS-)+c(H2S)=0.1mol/L,故D正确;
故选D.
点评:本题考查了盐的水解原理、溶液中离子浓度大小比较,题目难度中等,注意掌握判断溶液中离子浓度大小方法,明确盐的水解原理,能够利用电荷守恒、物料守恒、盐的水解比较溶液中各离子浓度大小.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、煤、石油、天然气均属于可再生的化石燃料 |
| B、糖类、油脂、蛋白质是人类重要的营养物质 |
| C、高温结构陶瓷、光导纤维均属于新型无机非金属材料 |
| D、塑料、合成纤维、合成橡胶是我们生活中常见的合成材料 |
用下列装置进行相应实验,能达到实验目的是( )
A、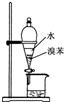 用如图所示装置分离出溴苯 |
B、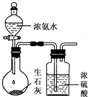 用如图所示装置制取干燥的氨气 |
C、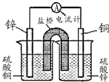 用如图设计成铜锌原电池装置 |
D、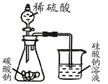 用如图证明氢化物稳定性SiH4>CH4>H2S |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断.下列说法不合理的是( )
| A、微粒X2-与Y2+核外电子排布相同,离子半径:X2->Y2+ |
| B、人们可在周期表的过渡元素中寻找催化剂、耐腐蚀和耐高温的合金材料 |
| C、由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F |
| D、Be元素与Al元素同处在周期表的金属与非金属的交界处,可推出:Be(OH)2+2OH-═BeO22-+2H2O |
下列关于胶体的说法中正确的是( )
| A、胶体外观不均匀 |
| B、胶体粒子能通过半透膜 |
| C、胶体不稳定,静置后容易产生沉淀 |
| D、胶体微粒做不停的无秩序运动 |
下列有机物命名正确的是( )
| A、2,4,4-三甲基戊烷 |
| B、2-乙基丁烷 |
| C、2,2,3,4-四甲基戊烷 |
| D、3,4,4-三甲基戊烷 |
苹果醋是一种由苹果发酵而成的食品.苹果酸( )是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )
)是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )
 )是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )
)是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )| A、可以与NaHCO3溶液反应产生CO2 |
| B、可以与乙醇发生酯化反应 |
| C、1mol的苹果酸最多能与2mol金属钠反应 |
D、苹果酸与  互为同分异构体 互为同分异构体 |
如图是周期表中短周期的一部分.已知A、B两元素原子的最外层电子数之和等于E元素原子的最外层电子数.下列有关说法正确的是( )
| C | D | |||
| A | B | E |
| A、元素B和E、B和D形成的化合物在固态时都属于分子晶体 |
| B、工业上可用A、D形成的化合物制取A的单质;B的单质在信息业有广泛用途 |
| C、与E同族的元素中,若简单阴离子的还原性越强,则该元素的最高价氧化物对应水化物的酸性也越强 |
| D、元素B的最简单氢化物分子的空间构型为正四面体,元素C的最简单氢化物的沸点比E的气态氢化物的沸点低 |