题目内容
用下列装置进行相应实验,能达到实验目的是( )
A、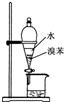 用如图所示装置分离出溴苯 |
B、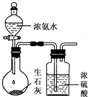 用如图所示装置制取干燥的氨气 |
C、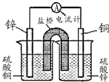 用如图设计成铜锌原电池装置 |
D、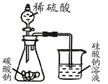 用如图证明氢化物稳定性SiH4>CH4>H2S |
考点:化学实验方案的评价
专题:实验评价题
分析:A.互不相溶的液体用分液分离;
B.氨气与浓硫酸反应生成硫酸铵;
C.左边锌与硫酸铜直接反应;
D.强酸反应制弱酸,非金属性S>C>Si.
B.氨气与浓硫酸反应生成硫酸铵;
C.左边锌与硫酸铜直接反应;
D.强酸反应制弱酸,非金属性S>C>Si.
解答:
解:A.溴苯和水互不相溶,能用分液分离,故A正确;
B.氨气与浓硫酸反应生成硫酸铵,应用碱石灰干燥,故B错误;
C.左边锌与硫酸铜直接反应,不形成原电池,故C错误;
D.强酸反应制弱酸,非金属性S>C>Si,氢化物稳定性H2S>CH4>SiH4,故D错误.
故选A.
B.氨气与浓硫酸反应生成硫酸铵,应用碱石灰干燥,故B错误;
C.左边锌与硫酸铜直接反应,不形成原电池,故C错误;
D.强酸反应制弱酸,非金属性S>C>Si,氢化物稳定性H2S>CH4>SiH4,故D错误.
故选A.
点评:本题考查化学实验方案的评价,涉及物质的分离、气体干燥、原电池以及非金属比较等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
相关题目
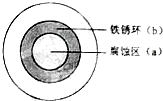 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )| A、液滴中的Cl - 由a区向b区迁移 |
| B、铁腐蚀严重的区域,生锈也严重 |
| C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH- 形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D、液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH- |
日本地震导致核电站泄露出大量的人工放射性核素,如131I(碘)、137Cs(铯)等.下列说法正确的是( )
| A、127I与131I为不同的核素,但具有相同的化学性质 |
| B、127I是碘元素稳定的同位素,与131I为互为同分异构体 |
| C、127I与131I的质量数不同,核外电子排布方式也不同 |
| D、铯为IA元素,常温时,0.1mol?L-1的137CsOH溶液,pH<13 |
下列说法正确的是( )
A、CH4(g)+
| ||
| B、在25℃、101kPa,1mol硫和2mol硫的燃烧热相等 | ||
| C、CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 | ||
| D、101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A、pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | ||||
B、0.1 mol?L-1 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO
| ||||
| C、物质的量浓度相等的HF和NaF溶液等体积混合后有:c(Na+)=c(HF)+c(F-) | ||||
| D、0.1 mol?L-1 NaHS溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
X、Y两元素的质子数之和为21,X原子的核外电子数比Y原子的核外电子数少5,则下列有关叙述中不正确的是( )
| A、X单质的固体是分子晶体 |
| B、Y单质能与某些金属氧化物反应 |
| C、Y单质能与酸反应,但不能与碱反应 |
| D、X、Y构成一种阴离子与硝酸反应可转化为Y的阳离子 |
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ?mol-1
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
| A、反应①中的能量变化如右图所示 | ||
| B、CH3OH转变成H2的过程一定要吸收能量 | ||
| C、根据①推知反应:CH3OH(l)+H2O(g)=CO2(g)+3H2(g)的△H>+49.0kJ?mol-1 | ||
D、根据②推知反应:CH3OH(l)+
|
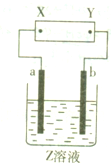 如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出.符合这一情况的是附表中的( )
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出.符合这一情况的是附表中的( )