题目内容
A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素.元素A的原子半径是所有元素中最小的.A、D同主族,B、C同周期,C、F最外层电子数相等,F的质量数为C的2倍,元素B的一种常见单质可做惰性电极材料,其最高价氧化物甲为常见温室气体.B、C、F的质子数之和等于E、G的质子数之和.
(1)由A、B、C、D四种元素组成的一种常见化合物乙是 (填写化学式);
(2)由C、D、E三种元素组成的一种化合物丙是 (填写化学式);
(3)G单质与水反应的离子方程式为 ;写出产物中具有强氧化物物质的电子式和结构式:
(4)书写甲的电子式
(5)用电子式表示A与D形成化合物AD过程: 用双线桥标出该物质与水反应的电子转移情况:
(6)过量甲通入丙溶液中的离子方程式是 .
(1)由A、B、C、D四种元素组成的一种常见化合物乙是
(2)由C、D、E三种元素组成的一种化合物丙是
(3)G单质与水反应的离子方程式为
(4)书写甲的电子式
(5)用电子式表示A与D形成化合物AD过程:
(6)过量甲通入丙溶液中的离子方程式是
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,元素A的原子半径是所有元素中最小的,则A是H元素;元素B的一种常见单质可做惰性电极材料,其最高价氧化物甲为常见温室气体,则B是C元素,甲是CO2;A、D同主族,且D原子序数大于B,为短周期元素,所以D是Na元素;B、C同周期,则B、C属于第二周期元素,C、F最外层电子数相等,位于同一主族,F的质量数为C的2倍,则C是O元素、F是S元素,G的原子序数大于F且为主族元素,所以G为Cl元素,B、C、F的质子数之和等于E、G的质子数之和,则E的原子序数为13,所以E是Al元素,
(1)由H、C、O、Na四种元素组成的一种常见化合物乙是碳酸氢钠;
(2)由O、Na、Al三种元素组成的一种化合物丙是偏铝酸钠;
(3)G是Cl元素,氯气和水反应生成HCl和HClO,产物中具有强氧化物物质是HClO;
(4)甲是二氧化碳,二氧化碳分子中每个O原子和C原子形成两对共用电子对;
(5)氢和钠形成氢化钠,是离子化合物,钠失去一个电子,氢得到一个电子,氢化钠与水反应时生成氢气和氢氧化钠,是氢化钠中-1价的氢还原水中+1价的氢;
(6)过量CO2通入NaAlO2溶液发生反应生成氢氧化铝沉淀和碳酸氢钠.
(1)由H、C、O、Na四种元素组成的一种常见化合物乙是碳酸氢钠;
(2)由O、Na、Al三种元素组成的一种化合物丙是偏铝酸钠;
(3)G是Cl元素,氯气和水反应生成HCl和HClO,产物中具有强氧化物物质是HClO;
(4)甲是二氧化碳,二氧化碳分子中每个O原子和C原子形成两对共用电子对;
(5)氢和钠形成氢化钠,是离子化合物,钠失去一个电子,氢得到一个电子,氢化钠与水反应时生成氢气和氢氧化钠,是氢化钠中-1价的氢还原水中+1价的氢;
(6)过量CO2通入NaAlO2溶液发生反应生成氢氧化铝沉淀和碳酸氢钠.
解答:
解:A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,元素A的原子半径是所有元素中最小的,则A是H元素;元素B的一种常见单质可做惰性电极材料,其最高价氧化物甲为常见温室气体,则B是C元素,甲是CO2;A、D同主族,且D原子序数大于B,为短周期元素,所以D是Na元素;B、C同周期,则B、C属于第二周期元素,C、F最外层电子数相等,位于同一主族,F的质量数为C的2倍,则C是O元素、F是S元素,G的原子序数大于F且为主族元素,所以G为Cl元素,B、C、F的质子数之和等于E、G的质子数之和,则E的原子序数为13,所以E是Al元素,
(1)由H、C、O、Na四种元素组成的一种常见化合物乙是碳酸氢钠,其化学式为NaHCO3,
故答案为:NaHCO3;
(2)由O、Na、Al三种元素组成的一种化合物丙是偏铝酸钠,其化学式为NaAlO2,
故答案为:NaAlO2;
(3)G是Cl元素,氯气和水反应生成HCl和HClO,离子方程式为Cl2+H2O=H++Cl-+HClO,HClO的电子式为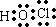 ,结构式为H-O-Cl,
,结构式为H-O-Cl,
故答案为:Cl2+H2O=H++Cl-+HClO;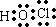 ;H-O-Cl;
;H-O-Cl;
(4)甲是二氧化碳,二氧化碳分子中每个O原子和C原子形成两对共用电子对,则其电子式为 ,
,
故答案为: ;
;
(5)氢和钠形成氢化钠,是离子化合物,钠失去一个电子,氢得到一个电子,NaH的形成过程为Na.+.H→Na+[:H]-,氢化钠与水反应时生成氢气和氢氧化钠,是氢化钠中-1价的氢还原水中+1价的氢,用双线桥表示反应的电子转移情况为 ,
,
故答案为:Na.+.H→Na+[:H]-; ;
;
(6)过量CO2通入NaAlO2溶液发生反应生成氢氧化铝沉淀和碳酸钠,离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
(1)由H、C、O、Na四种元素组成的一种常见化合物乙是碳酸氢钠,其化学式为NaHCO3,
故答案为:NaHCO3;
(2)由O、Na、Al三种元素组成的一种化合物丙是偏铝酸钠,其化学式为NaAlO2,
故答案为:NaAlO2;
(3)G是Cl元素,氯气和水反应生成HCl和HClO,离子方程式为Cl2+H2O=H++Cl-+HClO,HClO的电子式为
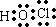 ,结构式为H-O-Cl,
,结构式为H-O-Cl,故答案为:Cl2+H2O=H++Cl-+HClO;
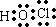 ;H-O-Cl;
;H-O-Cl;(4)甲是二氧化碳,二氧化碳分子中每个O原子和C原子形成两对共用电子对,则其电子式为
 ,
,故答案为:
 ;
;(5)氢和钠形成氢化钠,是离子化合物,钠失去一个电子,氢得到一个电子,NaH的形成过程为Na.+.H→Na+[:H]-,氢化钠与水反应时生成氢气和氢氧化钠,是氢化钠中-1价的氢还原水中+1价的氢,用双线桥表示反应的电子转移情况为
 ,
,故答案为:Na.+.H→Na+[:H]-;
 ;
;(6)过量CO2通入NaAlO2溶液发生反应生成氢氧化铝沉淀和碳酸钠,离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
点评:本题考查位置结构性质关系及其应用,涉及电子式、离子方程式书写等知识点,侧重考查学生对基本物质结构、基本理论的运用,注意氢化钠与水反应的化合价的变化,为易错点.

练习册系列答案
相关题目
下列说法正确的是( )
| A、镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| B、火电是将燃料中的化学能直接转化为电能的过程 |
| C、将煤粉碎了再燃烧可以提高煤的燃烧效率 |
| D、化学反应的限度不可以通过改变条件而改变 |



 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E元素+3价离子外围电子排布式为3d5.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E元素+3价离子外围电子排布式为3d5.回答下列问题: