题目内容
下列电离方程式书写正确的是( )
| A、H2CO3=2 H++CO32- |
| B、Ca(OH)2=Ca2++(OH)2- |
| C、K2SO4═2K++SO4-2 |
| D、NaHCO3=Na++HCO3- |
考点:电离方程式的书写
专题:离子反应专题
分析:先判断电解质,强电解质的电离用等号,弱电解质的电离用可逆号,并遵循质量守恒定律和电荷守恒,注意弱酸的酸根离子应保留整体,以此来解答.
A.碳酸为二元弱酸,分步电离;
B.角标转化为化学计量数;
C.硫酸根离子带两个单位的负电荷,应为SO42-;
D.NaHCO3为强电解质,电离出钠离子和碳酸氢根离子.
A.碳酸为二元弱酸,分步电离;
B.角标转化为化学计量数;
C.硫酸根离子带两个单位的负电荷,应为SO42-;
D.NaHCO3为强电解质,电离出钠离子和碳酸氢根离子.
解答:
解:A.H2CO3为弱酸,则电离方程式为H2CO3?H++HCO3-,HCO3-?H++CO32-,故A错误;
B.氢氧化钙电离时生成钙离子、氢氧根离子,其电离方程式为Ca(OH)2═Ca2++2OH-,故B错误;
C.硫酸钾中钾元素的化合价为+1价,硫酸根的化合价为-2价,所以硫酸钾解离成的钾离子带1个单位的正电荷、硫酸根离子带两个单位的负电荷,其电离方程式为:K2SO4═2K++SO42-,故C错误;
D.NaHCO3为强电解质,则电离方程式为NaHCO3═Na++HCO3-,故D正确;
故选D.
B.氢氧化钙电离时生成钙离子、氢氧根离子,其电离方程式为Ca(OH)2═Ca2++2OH-,故B错误;
C.硫酸钾中钾元素的化合价为+1价,硫酸根的化合价为-2价,所以硫酸钾解离成的钾离子带1个单位的正电荷、硫酸根离子带两个单位的负电荷,其电离方程式为:K2SO4═2K++SO42-,故C错误;
D.NaHCO3为强电解质,则电离方程式为NaHCO3═Na++HCO3-,故D正确;
故选D.
点评:本题考查电解质的电离方程式,明确电解质的强弱及电离方程式书写的方法即可解答,难度不大.

练习册系列答案
相关题目
现有四种元素的基态原子的电子排布式如下:则下列有关比较中,正确的是( )
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.
| A、p轨道中的未成对电子数:③>②>① |
| B、原子半径:③>②>① |
| C、电负性:③>①>② |
| D、最高正化合价:③>①>② |
NA代表阿伏加德罗常数的值下列有关叙述正确的是( )
| A、5.6g铁粉在2.24L氯气中充分燃烧,失去的电子数一定为0.3NA |
| B、标准状况下,15g一氧化氮和5.6L氧气混合后的分子总数为0.5NA |
| C、在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA |
| D、78gNa2S和Na2O2的混合物中含有的离子总数大于3NA |
下列说法正确的是( )
| A、在常温常压下,11.2LN2所含有的分子数为0.5NA |
| B、在标准状况下,22.4 L CO和N2的混合物的物质的量为1mol |
| C、在标准状况下,18g H2O的体积为22.4 L |
| D、1mol SO2的体积为22.4 L |
将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
| A、硫酸、纯碱、氯化钙 |
| B、盐酸、烧碱、硫酸铜 |
| C、碳酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钾 |
下列关于热化学反应的描述中正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)△H=+2×283.0kJ?mol-1 |
| C、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| D、1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
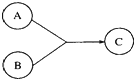 Ⅰ有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与溴的四氯化碳溶液发生加成反应,1molA能与1molNaHCO3溶液恰好完全反应.B所含元素种类与A相同,是厨房的调味品,其中碳的质量分数为52.2%,氢的质量分数为13%.试回答下列问题,
Ⅰ有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与溴的四氯化碳溶液发生加成反应,1molA能与1molNaHCO3溶液恰好完全反应.B所含元素种类与A相同,是厨房的调味品,其中碳的质量分数为52.2%,氢的质量分数为13%.试回答下列问题,
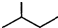 的名称为
的名称为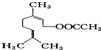
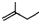
 最多
最多