题目内容
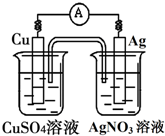 已知反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )
已知反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )| A、铜电极是正极,其电极反应为Cu-2e-=Cu2+ |
| B、银电极上发生还原反应,电极质量增加 |
| C、当铜电极质量减少0.64g时,电解质溶液中有0.02mol电子通过 |
| D、外电路中电子由银电极流向铜电极 |
考点:原电池和电解池的工作原理
专题:
分析:A、铜为负极,银为正极;
B、银为正极发生还原反应,银离子得电子;
C、当铜电极质量减少0.64g时,消耗铜的物质的量为0.01mol,外电路有0.02mol电子通过,内电路是离子的定向移动;
D、外电路中电子由负极铜转移到正极银.
B、银为正极发生还原反应,银离子得电子;
C、当铜电极质量减少0.64g时,消耗铜的物质的量为0.01mol,外电路有0.02mol电子通过,内电路是离子的定向移动;
D、外电路中电子由负极铜转移到正极银.
解答:
解:A、铜为负极,银为正极,负极的电极反应为Cu-2e-=Cu2+,故A错误;
B、银为正极发生还原反应,银离子得电子生成单质银,故B正确;
C、当铜电极质量减少0.64g时,消耗铜的物质的量为0.01mol,外电路有0.02mol电子通过,内电路是离子的定向移动,故C错误;
D、外电路中电子由负极铜转移到正极银,故D错误;
故选B.
B、银为正极发生还原反应,银离子得电子生成单质银,故B正确;
C、当铜电极质量减少0.64g时,消耗铜的物质的量为0.01mol,外电路有0.02mol电子通过,内电路是离子的定向移动,故C错误;
D、外电路中电子由负极铜转移到正极银,故D错误;
故选B.
点评:本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.

练习册系列答案
相关题目
糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质.下列有关说法正确的是( )
| A、糖类物质中只含有C、H、O三种元素 |
| B、蛋白质遇浓硝酸变成紫色 |
| C、油脂在人体中发生水解生成氨基酸 |
| D、糖类、蛋白质都能发生水解反应 |
下列四种x的溶液,分别加入盛有100mL2mol.L-1盐酸的烧杯中,并加入水稀释至500mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是( )
| A、20 mL,3mol.L-1 |
| B、20 mL,2mol.L-1 |
| C、10 mL,4mol.L-1 |
| D、10 mL,2mol.L-1 |
铅蓄电池的总反应式为:PbO2+Pb+2H2SO4
2PbSO4+2H2O,据此判断下列叙述正确的是( )
| 充电 |
| 放电 |
| A、放电时,H2SO4 浓度增加 |
| B、放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C、在充电时,电池中每转移1mol电子,理论上生成1mol硫酸 |
| D、在充电时,阴极发生的反应是PbSO4-2e-+2H2O=PbO2+SO2-4+4H+ |
某学习小组的同学查阅相关资料知氧化性:Cr2O72->Fe3+,设计了盐桥式的原电池,见图.盐桥中装有琼脂与饱和K2SO4溶液.下列叙述中正确的是( )


| A、甲烧杯的溶液中发生还原反应 |
| B、乙烧杯中发生的电极反应为:2Cr3++7H2O-6e-=Cr2O72-+14H+ |
| C、外电路的电流方向是从b到a |
| D、电池工作时,盐桥中的SO42- 移向乙烧杯 |
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象.可以通过下列装置所示实验进行探究.下列说法正确的是( )


| A、按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B、图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C、铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-═Cl2↑ |
| D、图Ⅲ装置的总反应为4Al+3O2+6H2O═4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑 |
某有机物X的结构简式如图所示,则下列有关说法中正确的是( )


| A、有机物X的分子式为C12H15O3 |
| B、X分子中含有1个手性碳原子 |
| C、X在一定条件下能发生加成、取代、消去等反应 |
| D、在Ni作催化剂的条件下,1 mol X最多能与4 mol H2加成 |