题目内容
某学习小组的同学查阅相关资料知氧化性:Cr2O72->Fe3+,设计了盐桥式的原电池,见图.盐桥中装有琼脂与饱和K2SO4溶液.下列叙述中正确的是( )


| A、甲烧杯的溶液中发生还原反应 |
| B、乙烧杯中发生的电极反应为:2Cr3++7H2O-6e-=Cr2O72-+14H+ |
| C、外电路的电流方向是从b到a |
| D、电池工作时,盐桥中的SO42- 移向乙烧杯 |
考点:原电池和电解池的工作原理
专题:
分析:由于氧化性Cr2O72->Fe3+,即Cr2O72-可以将Fe2+氧化为Fe3+,故在原电池中,Fe2+失电子被氧化,故a极为负极;Cr2O72-得电子被还原,故b极为正极.据此分析.
解答:
解:由于氧化性Cr2O72->Fe3+,即Cr2O72-可以将Fe2+氧化为Fe3+,故在原电池中,Fe2+失电子被氧化,故a极为负极;Cr2O72-得电子被还原,故b极为正极.
A、Fe2+失电子被氧化,即甲池发生氧化反应,故A错误;
B、乙烧杯中Cr2O72-得电子被还原:Cr2O72-+6e-+14H+=2Cr3++7H2O,故B错误;
C、外电路中电流由正极流向负极,即由b流向a,故C正确;
D、原电池中,阴离子移向负极,即SO42- 移向甲烧杯,故D错误.
故选C.
A、Fe2+失电子被氧化,即甲池发生氧化反应,故A错误;
B、乙烧杯中Cr2O72-得电子被还原:Cr2O72-+6e-+14H+=2Cr3++7H2O,故B错误;
C、外电路中电流由正极流向负极,即由b流向a,故C正确;
D、原电池中,阴离子移向负极,即SO42- 移向甲烧杯,故D错误.
故选C.
点评:本题考查了原电池中正负极的判断、电极反应式的书写和离子的移动,难度不大,应注意的是负极发生氧化反应,正极发生还原反应.

练习册系列答案
相关题目
 向Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液时,其沉淀的质量m和所加NaOH体积V之间的关系如图所示,则混合液中Al2(SO4)3与MgSO4的物质的量之比是( )
向Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液时,其沉淀的质量m和所加NaOH体积V之间的关系如图所示,则混合液中Al2(SO4)3与MgSO4的物质的量之比是( )| A、1:1 | B、1:2 |
| C、2:1 | D、1:3 |
 上海世博会上澳大利亚馆的外墙采用的是特 殊的耐风化钢覆层材料,外墙的颜色每天都在发生着变化,它会随空气中太阳、风雨、湿度的影响,逐渐结出一层锈斑,从橙色到赭红色的转变,看上去外观的生锈程度在增加,运用了钢材生锈原理.下列有关钢材生锈的说法正确的是( )
上海世博会上澳大利亚馆的外墙采用的是特 殊的耐风化钢覆层材料,外墙的颜色每天都在发生着变化,它会随空气中太阳、风雨、湿度的影响,逐渐结出一层锈斑,从橙色到赭红色的转变,看上去外观的生锈程度在增加,运用了钢材生锈原理.下列有关钢材生锈的说法正确的是( )| A、红色铁锈的主要成分是Fe(OH)3 |
| B、钢材在空气中的变化只有氧化还原反应 |
| C、空气中太阳、风雨、湿度对钢材的腐蚀有影响 |
| D、钢材在空气中的腐蚀主要为电化学腐蚀,其负极的反应为:Fe-3e-=Fe3+ |
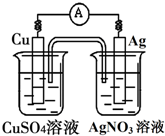 已知反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )
已知反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )| A、铜电极是正极,其电极反应为Cu-2e-=Cu2+ |
| B、银电极上发生还原反应,电极质量增加 |
| C、当铜电极质量减少0.64g时,电解质溶液中有0.02mol电子通过 |
| D、外电路中电子由银电极流向铜电极 |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
| A、NF3是氧化剂,H2O是还原剂 |
| B、NF3在潮湿空气中泄漏会看到红棕色气体 |
| C、每消耗0.2mol氧化剂,可收集到5.418L气体 |
| D、若生成1molHNO3,则转移NA个电子 |
下列说法正确的是( )
| A、分解反应一定是氧化还原反应 |
| B、非金属单质在氧化还原反应中一定作氧化剂 |
| C、氧化剂具有氧化性,还原剂具有还原性 |
| D、氧化剂在氧化还原反应中被氧化 |
工业上曾经利用铝热反应焊接钢轨,现在高层建筑爆破中常用铝热反应来熔断钢筋.铝热反应方程式如下:2A1十Fe2O3=2Fe十A12O3,对于该反应,下列说法正确的是( )
| A、该反应是置换反应 |
| B、还原剂是Fe |
| C、铝元素化合价升高,发生还原反应 |
| D、Fe2O3既不是氧化剂又不是还原剂 |
霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物.下列关于MMF的说法不正确的是( )


| A、MMF不能溶于水 |
| B、MMF能发生取代反应和消去反应 |
| C、1molMMF能与4mol氢气发生加成反应 |
| D、1molMMF能与含3molNaOH溶液完全反应 |