题目内容
12.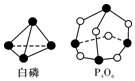 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )| A. | 释放1638 kJ的能量 | B. | 吸收1638 kJ的能量 | ||
| C. | 释放126 kJ的能量 | D. | 吸收126 kJ的能量 |
分析 反应热△H=反应物总键能-生成物总键能,据此计算判断.注意每摩尔P4中含有6molP-P键,以此解答.
解答 解:各化学键键能为P-P 198kJ•mol-1、P-O 360kJ•mol-1、O=O 498 kJ•mol-1.
反应热△H=反应物总键能-生成物总键能,由图可知:1个P分子中含有6个P-P,1个P4O6分子中含有12个P-O.1mol P4和3mol O2完全反应(P4+3O2=P4O6)生成1mol P4O6,所以反应P4+3O2=P4O6的反应热△H=6×198kJ•mol-1+3×498kJ•mol-1-12×360kJ•mol-1=-1638kJ•mol-1,反应放热1638kJ,
故选A.
点评 本题考查反应热与化学键键能的关系,为高频考点,侧重考查学生的分析、计算能力,难度中等,注意从物质能量、键能理解反应热.

练习册系列答案
相关题目
7.下列存放物质的方法中错误的是( )
| A. | Na可保存在CCl4中 | |
| B. | NaOH溶液盛装在带橡皮塞的试剂瓶中 | |
| C. | 用棕色细口试剂瓶存放氯水 | |
| D. | 漂白粉要密闭在容器中保存 |
3.101kPa时,S(s)+O2(g)═SO2(g)△H=-297.23kJ•mol-1.据此分析,下列说法中不正确的是( )
| A. | S的燃烧热为297.23 kJ•mol-1 | |
| B. | S升华是吸热过程 | |
| C. | 形成1 mol SO2的化学键释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量 | |
| D. | S(g)+O2(g)═SO2(g)放出的热量小于297.23 kJ |
4.下列叙述中正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu是负极 | |
| C. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 | |
| D. | 马口铁(镀锡铁)破损时与电解质溶液接触,锡先被破坏 |
1.化学与生活密切相关,下列说法正确的是( )
| A. | 碳酸钡可用作“钡餐”,是因为碳酸钡不溶于水 | |
| B. | 雷雨发庄稼是因为雷雨过后空气变得清新 | |
| C. | 聚氯乙烯在食品工业中常用作食品包装袋 | |
| D. | 纯碱可用作锅炉除垢时沉淀硫酸钙的转化剂 |
2.紫外线能杀菌消毒.其原理是( )
| A. | 溶解作用 | B. | 氧化作用 | C. | 盐析作用 | D. | 变性作用 |