题目内容
17.请根据0.1mol/L的氢氰酸钠(NaCN)溶液,回答下列问题:(1)氢氰酸钠溶液显碱 性,用离子方程式表示其原因:CN-+H2O?HCN+OH-
(2)氢氰酸钠溶液中离子浓度由大到小的关系是c(Na+)>c(CN-)>c(OHˉ)>c(H+)
(3)写出氢氰酸钠溶液中的三个守恒式c(Na+)+c(H+)=c(OH-)+c(CN-)、c(Na+)=c(HCN)+c(CN-)、c(OH-)=c(H+)+c(HCN).
分析 (1)NaCN是强碱弱酸盐,水解显碱性;
(2)CN-离子发生水解:CN-+H2O?HCN+OH-,水能发生电离:H2O?OH-+H+;据此分析离子浓度;
(3)电荷守恒是根据溶液显电中性来分析;
物料守恒是根据 CN-部分水解为HCN来分析;
质子守恒是根据在NACN溶液中,所有的氢离子和氢氧根均来自水的电离来分析.
解答 解:(1)NaCN是强碱弱酸盐,水解显碱性,离子方程式为:CN-+H2O?HCN+OH-;故答案为:碱;CN-+H2O?HCN+OH-;
(2)CN-离子发生水解:CN-+H2O?HCN+OH-,水能发生电离:H2O?OH-+H+,故离子浓度大小关系为:c(Na+)>c(CN-)>c(OHˉ)>c(H+),
故答案为:c(Na+)>c(CN-)>c(OHˉ)>c(H+);
(3)电荷守恒是根据溶液显电中性来列式,即溶液中的氢离子所带正电荷浓度等于阴离子所带负电荷浓度,故为:c(Na+)+c(H+)=c(OH-)+c(CN-);
物料守恒是根据 CN-部分水解为HCN来列式,故有c(Na+)=c(HCN)+c(CN-);
质子守恒是根据在NACN溶液中,所有的氢离子和氢氧根均来自水的电离,故有:c(OH-)=c(H+)+c(HCN),
故答案为:c(Na+)+c(H+)=c(OH-)+c(CN-);c(Na+)=c(HCN)+c(CN-);c(OH-)=c(H+)+c(HCN).
点评 本题考查了离子浓度大小比较,题目难度不大,明确电荷守恒、物料守恒及质子守恒的含义为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
12.在强碱性溶液中,下列各组离子能在同一溶液里大量共存的是( )
| A. | Na+、Al3+、Cl- | B. | K+、H+、SO42- | C. | Na+、HCO3-、NO3- | D. | K+、Na+、AlO2- |
8.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA | |
| B. | 物质的量浓度为0.1mol•L-1的MgCl2溶液中,含有Cl-个数为0.2NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | 常温下,22g CO2和N2O混合气体中,含有的原子数目为1.5NA |
5.将溶质的质量分数为10%的KOH溶液加热蒸发掉100g水后,得到溶质的质量分数为35%的溶液50mL,此时溶液的物质的量浓度为( )
| A. | 5mol•L-1 | B. | 3.25mol•L-1 | C. | 7mol•L-1 | D. | 6.25mol•L-1 |
12.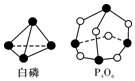 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )| A. | 释放1638 kJ的能量 | B. | 吸收1638 kJ的能量 | ||
| C. | 释放126 kJ的能量 | D. | 吸收126 kJ的能量 |
2.同温同压下,三个等体积的干燥圆底烧瓶中分别充满:①混有少量空气的HCl;②NO2;③体积比为4:1的NO2和O2,进行喷泉实验.经充分反应后烧瓶内溶质的物质的量浓度之比为( )
| A. | 1:1:1 | B. | 4:4:5 | C. | 5:5:4 | D. | 无法确定 |
9.向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,在一定条件下发生反应,各物质浓度随时间的变化如甲图所示[t0~t1阶段c(B)未画出].图乙为t2时刻后改变条件平衡体系中化学反应速率随时间变化的情况,四个阶段各改变一种条件并且改变的条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )
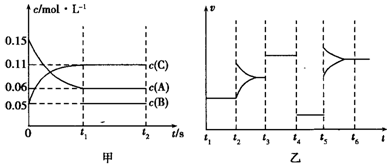

| A. | 若t1=15s,生成物C在t0~t1时间段的化学反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段可能是增大压强 |
6.A~G各物质间的关系如图所示,其中B、D为气体单质.则下列说法错误的是( )
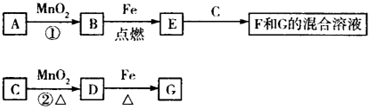

| A. | 已知C的浓溶液在催化剂存在的条件下加热,能与B反应生成D,由此可以推断B的氧化性比MnO2强 | |
| B. | 反应②的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O | |
| C. | 新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+,后者可抑制Fe2+的水解 | |
| D. | 若反应①在常温下进行,则1 mol A在反应中能转移1 mol电子 |
7.在密闭容器中发生反应:mA(g)+nB(g)?pC(g)+qD(g) 反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,B的浓度为原平衡状态的2.2倍.下列叙述不正确的是( )
| A. | 平衡向逆反应方向移 动 | B. | (m+n)<(p+q) | ||
| C. | D的物质的量浓度小于原平衡 | D. | B的转化率变小 |