题目内容
7.标准状况下,1体积水吸收500体积NH3后,所得氨水密度为0.9g•cm-3,求氨水中溶质的质量分数和氨水的物质的量浓度各为多少?分析 求出氨气的物质的量n=$\frac{V}{{V}_{m}}$mol,然后求出质量m=nM,从而求出所得溶液的质量分数$ω=\frac{{m}_{溶质}}{{m}_{溶液}}×100%$,并根据物质的量浓度c=$\frac{1000ρω}{M}$来计算物质的量浓度.
解答 解:设氨气的体积为500L,则水的体积为1L.
标况下500L氨气的物质的量n=$\frac{V}{{V}_{m}}$mol=$\frac{500L}{22.4L/mol}=22.3mol$,故氨气的质量m=nM=22.3mol×17g/mol=379.5g,故所得溶液的质量分数$ω=\frac{{m}_{溶质}}{{m}_{溶液}}×100%$=$\frac{379.5g}{379.5g+1000g}×100%$=27.5%;
溶液的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×0.9×27.5%}{17}$=14.6mol/L.
答:所得氨水的质量分数为27.5%,物质的量浓度为14.6mol/L.
点评 本题考查了溶液质量分数和物质的量浓度的计算,难度不大,应注意公式的掌握和运用.

练习册系列答案
相关题目
2.常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,该溶液可能是( )
| A. | 一定浓度的CH3COONa溶液 | B. | 一定浓度的氨水溶液 | ||
| C. | 一定浓度的NaHSO4溶液 | D. | pH等于5的醋酸溶液 |
18.如图为某燃煤电厂处理废气的装置示意图,下列说法错误的是( )
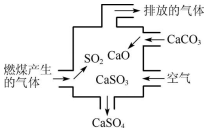

| A. | 使用此装置可以减少导致酸雨的气体的排放 | |
| B. | 该装置内只发生了化合反应 | |
| C. | 总反应可表示为2SO2+2CaCO3+O2?2CaSO4+2CO2 | |
| D. | 若排放的气体能使澄清石灰水变浑浊,说明该气体中含有SO2 |
15.物质的量浓度相同的NaCl、MgCl 2、AlCl 3 三种溶液,当溶液的体积比为1:2:3时,用相同物质的量浓度的AgNO3 溶液将Cl-完全沉淀,则需AgNO3溶液的体积比为( )
| A. | 1:1:1 | B. | 3:4:3 | C. | 1:4:9 | D. | 1:2:3 |
12.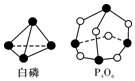 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )| A. | 释放1638 kJ的能量 | B. | 吸收1638 kJ的能量 | ||
| C. | 释放126 kJ的能量 | D. | 吸收126 kJ的能量 |
19.下列叙述正确的是( )
| A. | 溶液、胶体和悬浊液三种分散系的本质区别是分散质微粒直径的大小 | |
| B. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其正极上发生的反应为:CH3OH-6e-+8OH-=CO32-+6H2O | |
| C. | 在铁上镀铜时,金属铜作阴极 | |
| D. | 电解法精炼铜时,电解质溶液中铜离子浓度一定不变 |
16.下列仅能在水溶液中导电的电解质是( )
| A. | SO2 | B. | NH4Cl | C. | Na2CO3 | D. | NaCl |
17.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| C. | 高温和日常用的消毒剂均可使禽流感病毒变性 | |
| D. | 误食重金属盐引起人体中毒,可饮用大量的食盐水解毒 |