题目内容
4.下列叙述中正确的是( )| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu是负极 | |
| C. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 | |
| D. | 马口铁(镀锡铁)破损时与电解质溶液接触,锡先被破坏 |
分析 A.原电池的两极可为金属,也可为金属和非金属;
B.负极为较活泼金属;
C.根据锌和转移电子之间的关系式计算;
D.作原电池负极的金属易被腐蚀.
解答 解:A.原电池的两极可为金属,也可为金属和非金属,常用石墨作正极,如为燃料电池,两个电极都可为非金属,故A错误;
B.负极为较活泼金属,应为锌,故B错误;
C.铜、锌原电池工作时,若有13g锌被溶解,电路中通过的电子=$\frac{13g}{65g/mol}$×2=0.4mol,故C正确;
D.锡、铁和电解质溶液构成的原电池中,铁易失电子作负极,锡作正极,所以铁易被腐蚀,故D错误;
故选C.
点评 本题考查了原电池原理及金属的腐蚀与防护,根据原电池正负极上反应类型的解答,难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
19.有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
| A. | 盐酸 | B. | 烧碱溶液 | C. | 氨水 | D. | KSCN溶液 |
15.物质的量浓度相同的NaCl、MgCl 2、AlCl 3 三种溶液,当溶液的体积比为1:2:3时,用相同物质的量浓度的AgNO3 溶液将Cl-完全沉淀,则需AgNO3溶液的体积比为( )
| A. | 1:1:1 | B. | 3:4:3 | C. | 1:4:9 | D. | 1:2:3 |
12.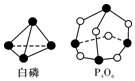 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )| A. | 释放1638 kJ的能量 | B. | 吸收1638 kJ的能量 | ||
| C. | 释放126 kJ的能量 | D. | 吸收126 kJ的能量 |
19.下列叙述正确的是( )
| A. | 溶液、胶体和悬浊液三种分散系的本质区别是分散质微粒直径的大小 | |
| B. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其正极上发生的反应为:CH3OH-6e-+8OH-=CO32-+6H2O | |
| C. | 在铁上镀铜时,金属铜作阴极 | |
| D. | 电解法精炼铜时,电解质溶液中铜离子浓度一定不变 |
9.向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,在一定条件下发生反应,各物质浓度随时间的变化如甲图所示[t0~t1阶段c(B)未画出].图乙为t2时刻后改变条件平衡体系中化学反应速率随时间变化的情况,四个阶段各改变一种条件并且改变的条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )
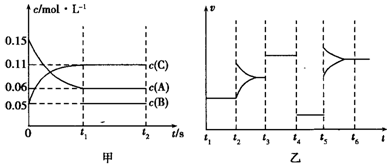

| A. | 若t1=15s,生成物C在t0~t1时间段的化学反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段可能是增大压强 |
16.下列仅能在水溶液中导电的电解质是( )
| A. | SO2 | B. | NH4Cl | C. | Na2CO3 | D. | NaCl |
13.下列说法中正确的是( )
| A. | s区都是金属元素 | B. | 所有非金属元素都在p区 | ||
| C. | 稀有气体在ds区 | D. | s区都是主族元素 |
14.关于反应2Na2O2+2CO2═2Na2CO3+O2 的下列说法正确的是( )
| A. | CO2是还原剂,在该反应中被氧化 | |
| B. | Na2O2是氧化剂,在该反应中发生氧化反应 | |
| C. | 氧化剂和还原剂的物质的量之比为1:2 | |
| D. | 若有2 mol Na2O2参加反应,则有2 mol电子转移 |