题目内容
12.与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5 OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)2.分析 K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,正极上FeO42-得电子和H2O反应生成Fe(OH)3;负极上Zn失电子和OH-反应生成Zn(OH)2,在正负极得失电子相等的条件下,两个电极反应式相加即得电池反应式.
解答 解:K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,正极上FeO42-得电子和H2O反应生成Fe(OH)3,电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5 OH-;
负极上Zn失电子和OH-反应生成Zn(OH)2,在正负极得失电子相等的条件下,两个电极反应式相加即得电池反应式,电池反应式为3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)2,
故答案为:FeO42-+3e-+4H2O=Fe(OH)3+5 OH-;3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)2.
点评 本题考查电极反应式的书写,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写,题目难度中等.

练习册系列答案
相关题目
2.下列有关物理量与其相应的单位不匹配的是( )
| A. | 摩尔质量:g | B. | 气体摩尔体积:L/mol-1 | ||
| C. | 物质的量:mol | D. | 物质的量浓度:g/mol-1 |
3.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 1.7 g NH3含有的电子数为NA | |
| C. | 标准状况下,11.2 LH2O含有的分子数为0.5 NA | |
| D. | 22.4 L氧气含有的分子数为NA |
20.下列反应既是氧化还原反应,又是放热反应的是( )
| A. | 铝片和稀硫酸反应 | B. | 灼热的炭与二氧化碳反应 | ||
| C. | 氢氧化钙与氯化铵反应 | D. | 盐酸和氢氧化钠反应 |
7.下列关于化石燃料的加工说法正确的是( )
| A. | 石油裂解气和水煤气的主要成分都是甲烷 | |
| B. | 石油分馏是化学变化,可得到汽油、煤油 | |
| C. | 化石燃料所存贮的大量能量,实质是来源于太阳能 | |
| D. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 |
17.下列说法错误的是( )
| A. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 向醋酸溶液中加水可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 |
18.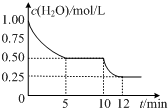 在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )
在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )
 在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )
在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )| A. | 0~5min内,v (H2)=0.05mol/(L•min) | |
| B. | 5min时该反应的K值一定小于12 min时的K值 | |
| C. | 10 min时,改变的外界条件可能是减小压强 | |
| D. | 5min时该反应的v (正)大于11 min 时的v (逆) |