题目内容
下列有关溶液中微粒浓度关系的叙述正确的是( )
| A、0.1 mol?L-1NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| D、25℃时,pH=7的NH4Cl与NH3?H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
考点:离子浓度大小的比较
专题:
分析:A、铵根水解导致离子浓度减小;
B、据物料守恒即n(Na)=n(Cl)=n(C)解答;
C、据电荷守恒解答;
D、不知道NH4Cl与NH3?H2O的浓度,无法比较c(H+)=c(OH-)与c(NH4+)=c(Cl-)的大小.
B、据物料守恒即n(Na)=n(Cl)=n(C)解答;
C、据电荷守恒解答;
D、不知道NH4Cl与NH3?H2O的浓度,无法比较c(H+)=c(OH-)与c(NH4+)=c(Cl-)的大小.
解答:
解:A、铵根水解导致离子浓度减小,应为c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B、据物料守恒知n(Na)=n(Cl)=n(C),Cl在NaClO溶液中以HClO和ClO-的形式存在,有c(HClO)+c(ClO-)=c(Na+)NaClO电离出来的,C在溶液中以HCO3-、H2CO3和CO32-的形式存在,c(HCO3-)+c(H2CO3)+c(CO32-)=c(Na+)NaHCO3电离出来的,c(Na+)NaClO电离出来的=c(Na+)NaHCO3电离出来的,故B正确;
C、在CH3COOH与CH3COONa混合溶液中存在电荷守恒,c(H+)+c(Na+)=c(CH3COO-)+c(OH-),溶液显酸性,说明c(H+)>c(OH-),所以c(Na+)<c(CH3COO-),故C正确;
D、中性NH4Cl与NH3?H2O混合溶液中,c(H+)=c(OH-),c(NH4+)=c(Cl-),不知道NH4Cl与NH3?H2O的浓度,无法比较c(H+)=c(OH-)与c(NH4+)=c(Cl-)的大小,故D错误;
故选BC.
B、据物料守恒知n(Na)=n(Cl)=n(C),Cl在NaClO溶液中以HClO和ClO-的形式存在,有c(HClO)+c(ClO-)=c(Na+)NaClO电离出来的,C在溶液中以HCO3-、H2CO3和CO32-的形式存在,c(HCO3-)+c(H2CO3)+c(CO32-)=c(Na+)NaHCO3电离出来的,c(Na+)NaClO电离出来的=c(Na+)NaHCO3电离出来的,故B正确;
C、在CH3COOH与CH3COONa混合溶液中存在电荷守恒,c(H+)+c(Na+)=c(CH3COO-)+c(OH-),溶液显酸性,说明c(H+)>c(OH-),所以c(Na+)<c(CH3COO-),故C正确;
D、中性NH4Cl与NH3?H2O混合溶液中,c(H+)=c(OH-),c(NH4+)=c(Cl-),不知道NH4Cl与NH3?H2O的浓度,无法比较c(H+)=c(OH-)与c(NH4+)=c(Cl-)的大小,故D错误;
故选BC.
点评:本题考查了溶液中离子浓度大小比较,注意电荷守恒和物料守恒的应用,题目难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
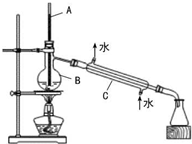 现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )
现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )| 物质 | 沸点/℃ | 溶解性 |
| 乙二醇 | 198 | 易溶于水和乙醇 |
| 丙三醇 | 290 | 能跟水、乙醇任意比互溶 |
| A、在正确操作情况下,锥形瓶中收集到的物质为乙二醇 |
| B、仪器C中进出水口方向错误 |
| C、仪器A为玻璃棒,所处位置错误 |
| D、仪器B的名称为圆底烧瓶. |
从柑橘中炼制出有机物 (如图)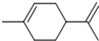 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A、分子式C10H14 |
| B、常温下为液态,难溶于水 |
| C、它属于芳香烃 |
| D、1mol该物质与1molHCl加成所得产物有4种 |
NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:关于NM-3和D-58的叙述,正确的是( )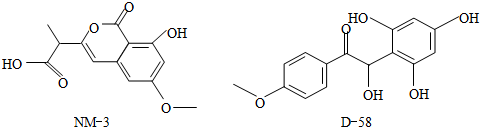

| A、都能与NaOH溶液反应,且等量时消耗的NaOH相同 |
| B、都不能与NaHCO3溶液反应产生CO2 |
| C、都不能发生消去反应,原因完全相同 |
| D、都能与溴水反应,原因完全相同 |
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )


A、反应开始2 min内,v(B)=
| ||
| B、t1时改变的条件可能是升高温度 | ||
| C、t3时改变的条件可能是加压,此时c(B)不变 | ||
| D、t4时可能是使用了催化剂,此时c(B)不变 |
下列有关金属的说法正确的是( )
| A、生铁与钢的区别在于生铁含碳杂质,而钢不含 |
| B、铜在自然界中的含量高,所以铜是人类最早使用的金属 |
| C、黑色金属材料包括铁、铬、锰及其化合物 |
| D、金属一般都具有导电性、导热性、延展性 |

 (1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为