题目内容
 用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.(1)X极与电源的
(2)已知离子交换膜只允许一类离子通过,则M为
(3)若制得标准状况下5.6L氧气,则生成氢氧化钾的质量是
考点:电解原理
专题:电化学专题
分析:(1)根据加入的物质知,X电极附近生成硫酸,Y电极附近生成氢氧化钾,则X电极上氢氧根离子放电,Y电极上氢离子放电,所以X是阳极,Y是阴极,阳极与电源正极相连;阳极上生成氧气,阴极上生成氢气;
(2)电解过程中,电解质溶液中阳离子向阴极移动,阴离子向阳极移动;
(3)根据转移电子守恒计算生成硫酸的质量.
(2)电解过程中,电解质溶液中阳离子向阴极移动,阴离子向阳极移动;
(3)根据转移电子守恒计算生成硫酸的质量.
解答:
解:(1)题图中左边加入含硫酸的水,右侧加入含KOH的水,说明左边制硫酸,右边制备KOH溶液,氢氧根离子在阳极放电,同时电解后溶液呈酸性,氢离子在阴极放电,同时电解后溶液呈碱性,则X为阳极,Y为阴极,所以X连接电源正极;
Y电极上氢离子放电生成氢气,所以氢气从C口导出,
故答案为:正;C;
(2)OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜;
故答案为:阴离子;
(3)n(O2)=
=0.25mol,根据4OH--4e-═2H2O+O2↑知,失电子的物质的量为1mol,Y极的反应式为2H++2e-═H2↑,根据得失电子守恒知,生成氢氧根的物质的量为1mol,根据氢氧根守恒得生成1mol KOH,m(KOH)=nM=1mol×56g/mol=56g,
故答案为:56g.
Y电极上氢离子放电生成氢气,所以氢气从C口导出,
故答案为:正;C;
(2)OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜;
故答案为:阴离子;
(3)n(O2)=
| 5.6L |
| 22.4L/mol |
故答案为:56g.
点评:本题考查了原电池和电解池原理,正确推断电解池阴阳极是解本题关键,根据加入水溶液的溶质确定电极产物,结合电极产物确定阴阳极,再结合转移电子守恒进行有关计算,难度中等.

练习册系列答案
相关题目
NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:关于NM-3和D-58的叙述,正确的是( )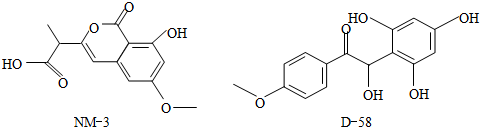

| A、都能与NaOH溶液反应,且等量时消耗的NaOH相同 |
| B、都不能与NaHCO3溶液反应产生CO2 |
| C、都不能发生消去反应,原因完全相同 |
| D、都能与溴水反应,原因完全相同 |
一定条件下,在可变容积的密闭容器中进行下列可逆反应下列说法正确的是( )
S2Cl2(l)+Cl2(g)?2SCl2(l);△H=-51.16kJ?mol-1
浅黄色 鲜红色.
S2Cl2(l)+Cl2(g)?2SCl2(l);△H=-51.16kJ?mol-1
浅黄色 鲜红色.
| A、达到平衡时,抽出少量氯气,反应混合液颜色变深 |
| B、加入少量SCl2,平衡向逆反应方向移动 |
| C、单位时间内生成n mol S2Cl2,同时生成2n mol SCl2时,反应达到平衡 |
| D、达平衡时,升高温度,混合液的颜色将变浅 |
下列叙述正确的是( )
| A、为防止富脂食品氧化变质可以在包装袋中加入生石灰 |
| B、用医用酒精消毒是因为酒精可以使蛋白质发生盐析 |
| C、绿色食品是不含任何化学物质的食品 |
| D、钠可把钛、锆、铌、钽等金属从它们的熔融的卤化物里还原出来 |
下列化学基本用语或表达正确的是( )
| A、Cu原子的激发态简化电子排布式为[Ar]3d104s1 |
| B、Fe原子的外围电子排布式为4s2 |
C、丙烷分子的比例模型: |
D、CH4Si的结构式: |
 (1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: 如图Ⅰ为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图Ⅰ为实验室制取蒸馏水的装置示意图,根据图示回答下列问题. (1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为