题目内容
12. 向一容积为5L的恒容密闭容器内,充入0.2mol CO和0.4mol H2O,在一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H>0.反应中CO2的浓度(c) 随时间(t)的变化关系如图所示.
向一容积为5L的恒容密闭容器内,充入0.2mol CO和0.4mol H2O,在一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H>0.反应中CO2的浓度(c) 随时间(t)的变化关系如图所示.回答下列问题:
(1)下列叙述能判断该反应达到平衡状态的是①④(填序号).
①H2O的质量不再变化 ②混合气体的总压强不再变化
③CO、H2O、CO2、H2的浓度都相等 ④单位时间内生成amol CO,同时生成amol H2
(2)0~10min时段,反应速率v(H2)=0.003 mol.L-1.min-1;反应达到平衡时,c(H2O)=0.05 mol.L-1,CO的转化率为75%.
分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)0~10min时段,反应速率v(CO2)=$\frac{0.03}{10}$=0.003mol•(L•min)-1;反应达到平衡时,
CO(g)+H2O(g)?CO2(g)+H2 (g)
起始量浓度:0.04 0.08 0 0
变化量:0.03 0.03 0.03 0.03
平衡量:0.01 0.05 0.03 0.03
c(H2O)=0.05 mol•(L•min)-1,CO的转化率为:$\frac{0.03}{0.04}$×100%=75%.
解答 解:(1)①H2O的质量不再变化,说明正逆反应速率相等,达平衡状态,故正确;
②两边气体计量数相等,混合气体的总压强一直不再变化,故错误;
③达平衡时CO、H2O、CO2、H2的浓度不变,但不一定相等,故错误;
④单位时间内生成amol CO等效于消耗amol H2,同时生成amol H2,说明正逆反应速率相等,达平衡状态,故正确;
故选:①④;
(2)0~10min时段,反应速率v(H2)=v(CO2)=$\frac{0.03}{10}$=0.003mol•(L•min)-1;反应达到平衡时,
CO(g)+H2O(g)?CO2(g)+H2 (g)
起始量浓度:0.04 0.08 0 0
变化量:0.03 0.03 0.03 0.03
平衡量:0.01 0.05 0.03 0.03
c(H2O)=0.05 mol•(L•min)-1,CO的转化率为:$\frac{0.03}{0.04}$×100%=75%,
故答案为:0.003 mol.L-1.min-1;0.05 mol.L-1;75%
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 微粒浓度关系:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] |
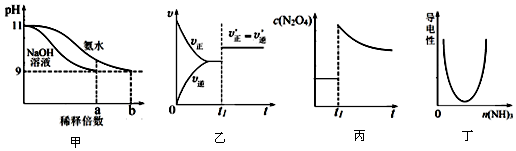
| A. | 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100 | |
| B. | 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂 | |
| C. | 图丙表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| D. | 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
| A. | a1>a2,c1>c2 | B. | a1<a2,c1<c2 | C. | a1>a2,c1<c2 | D. | a1<a2,c1>c2 |
| A. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 浊液的分散质粒子直径大于l00nm,不能通过滤纸 |

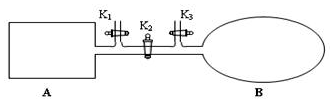 我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.
我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.