题目内容
9.图中A、B、C均为中学常见物质.室温下A为固体,B和C均为气体,在适宜的条件下,它们可以按框图关系进行反应: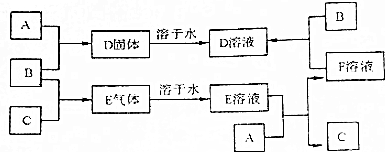
请回答下列问题:
(1)A所属元素类别为金属(填“金属”或“非金属”).
(2)写出B、C的化学式:BCl2,CH2.
(3)B与F溶液反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-.
(4)若将F溶液在空气中蒸干、灼烧,所得固体的化学式为Fe2O3.
分析 A、B、C为中学化学中常见的单质,室温下,A为固体,B和C均为气体.结合图中转化可知,A为固体,常见为碳、钠、镁、铝、铁等,B、C为气体单质,常见有氯气、氧气、氢气、氮气等,固体A和气体B反应生成的D是固体,说明A为金属不为碳,E溶液能与金属反应,且E是两种气体反应所得产物,则E应为酸,C应为H2,所以B为Cl2,E为HCl,D为金属和盐酸反应生成的氯化物盐,此盐可以直接由A和Cl2反应得到,B与F溶液反应生成D,说明A为变价金属铁,F为FeCl2,D为FeCl3,以此来解答.
解答 解:A、B、C为中学化学中常见的单质,室温下,A为固体,B和C均为气体.结合图中转化可知,A为固体,常见为碳、钠、镁、铝、铁等,B、C为气体单质,常见有氯气、氧气、氢气、氮气等,固体A和气体B反应生成的D是固体,说明A为金属不为碳,E溶液能与金属反应,且E是两种气体反应所得产物,则E应为酸,C应为H2,所以B为Cl2,E为HCl,D为金属和盐酸反应生成的氯化物盐,此盐可以直接由A和Cl2反应得到,B与F溶液反应生成D,说明A为变价金属铁,F为FeCl2,D为FeCl3,
(1)A所属元素类别为金属,故答案为:金属;
(2)B、C的化学式分别为Cl2、H2,故答案为:Cl2;H2;
(3)B与F溶液反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-,故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
(4)若将F溶液在空气中蒸干、灼烧,水解生成的HCl易挥发,氢氧化铁分解生成氧化铁,所得固体的化学式为Fe2O3,故答案为:Fe2O3.
点评 本题考查无机物的推断,为高频考点,把握铁及其化合物的性质、相互转化为解答的关键,侧重分析与推断能力的考查,注意B为氯气、A为Fe为推断的突破口,题目难度不大.

| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加水,将湿润的红色石蕊试纸放在试管口 | |
| C. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
| A. | 正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 | |
| B. | 乙醇依次通过消去、取代、加成反应可生成乙二醇 | |
| C. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
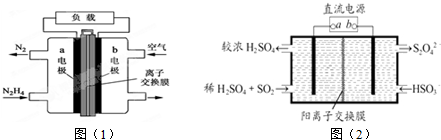
| A. | 图(1)中的a电极应与 图(2)的a相连 | |
| B. | 图(1)中a电极应的反应方程式为:N2H4+4OH--4e-═N2+4H2O | |
| C. | 用该燃料电池作为装置图(2)的直流电,吸收1 molSO2至少需要通人 0.5 mol N2H4 | |
| D. | 图(1)中OH-由阴离子交换膜从左流向右,图(2)中H+由阳离子交换膜从右流向左 |
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ/mol
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ/mol) | 497 | 803 | 1072 |
(2)在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)达到平衡状态,反应过程中反应物浓度随时间的变化如图1所示.
①该反应的平衡常数K的计算式为$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$(mol.L)-1,千10min内N2平均反应速率v(N2)0.02mol/(L•min)
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,则此时:v正=v逆(天“>”、“>”或“=”)
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,NO的浓度对应的点应是图1中的B(填字母)
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示,若不适用CO,纬度超过775K,发现NO的分解率降低,其可能的原因是NO的分解反应为放热反应,升高温度有利于反应逆向进行
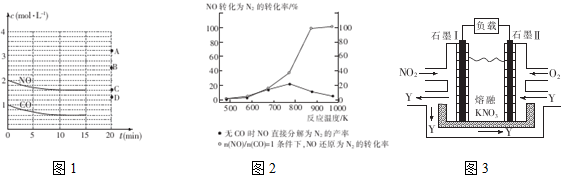
Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制 成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的反应电极反应式为NO2-e-+NO3-═N2O5相同条件下,消耗的O2和 NO2的体积比为1:4.
| A. | C3H8是折线形极性分子 | |
| B. | 只有过渡金属才能接受电子对形成配合物 | |
| C. | 乳酸[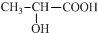 ]中存在一个手性碳原子 ]中存在一个手性碳原子 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子,而HClO中非羟基氧原子个数为0 |
 的一氯代物有( )
的一氯代物有( )| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
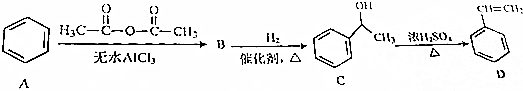
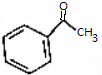 .
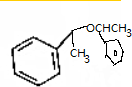
.
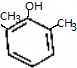 .
.