题目内容
14.将8.7gMnO2与足量的浓盐酸共热来制取氯气.有关说法正确的为( )| A. | 可制得14.2g氯气 | B. | 被氧化的HCl的质量为14.6g | ||
| C. | 被氧化的HCl的质量为7.3g | D. | 转移的电子的物质的量为0.2mol |
分析 二氧化锰与浓盐酸在加热条件下反应生成氯气,方程式:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,反应中每消耗1mol二氧化锰,消耗4mol氯化氢,转移2mol电子,生成1mol氯气,反应中氯化氢有一半表现为酸性,一半表现为还原性,据此解答.
解答 解:物质的量为:$\frac{8.7g}{87g/mol}$=0.1mol,依据方程式:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,可知消耗氯化氢物质的量为0.4mol,转移电子数为0.2mol,生成氯气物质的量为0.1mol,质量为0.1mol×71g/mol=7.1g,被氧化的氯气物质的量为0.2mol,质量为0.2mol×36.5g/mol=7.3g,
故选CD.
点评 本题考查了有关方程式的计算及氧化还原反应基本概念,熟悉氧化还原反应基本规律,明确氯气在反应中表现的性质是解题关键,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
4.已知氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ/mol
则反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)△K=-571kJ/mol
(2)在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)达到平衡状态,反应过程中反应物浓度随时间的变化如图1所示.
①该反应的平衡常数K的计算式为$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$(mol.L)-1,千10min内N2平均反应速率v(N2)0.02mol/(L•min)
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,则此时:v正=v逆(天“>”、“>”或“=”)
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,NO的浓度对应的点应是图1中的B(填字母)
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示,若不适用CO,纬度超过775K,发现NO的分解率降低,其可能的原因是NO的分解反应为放热反应,升高温度有利于反应逆向进行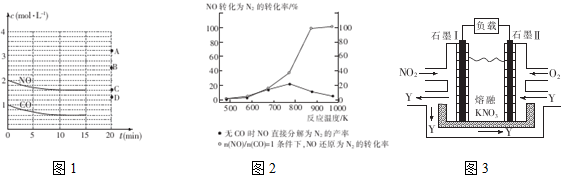
Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制 成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的反应电极反应式为NO2-e-+NO3-═N2O5相同条件下,消耗的O2和 NO2的体积比为1:4.
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ/mol
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ/mol) | 497 | 803 | 1072 |
(2)在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)达到平衡状态,反应过程中反应物浓度随时间的变化如图1所示.
①该反应的平衡常数K的计算式为$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$(mol.L)-1,千10min内N2平均反应速率v(N2)0.02mol/(L•min)
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,则此时:v正=v逆(天“>”、“>”或“=”)
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,NO的浓度对应的点应是图1中的B(填字母)
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示,若不适用CO,纬度超过775K,发现NO的分解率降低,其可能的原因是NO的分解反应为放热反应,升高温度有利于反应逆向进行

Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制 成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的反应电极反应式为NO2-e-+NO3-═N2O5相同条件下,消耗的O2和 NO2的体积比为1:4.
5.下列关于胶体和溶液区别的叙述中,正确的是( )
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质粒子一定不带电,胶体中分散质粒子带有电荷 | |
| C. | 溶液中溶质粒子的运动有规律,而胶体粒子的运动无规律 | |
| D. | 溶液中通过一束光线时无特殊现象,胶体中通过一束光线时有明显的光带 |
2.下列叙述正确的是( )
| A. | 由分子组成的物质中不一定存在共价键 | |
| B. | 金刚石、石墨、足球烯均是碳元素的同素异形体,性质都相似 | |
| C. | 由非金属元素组成的晶体一定是分子晶体 | |
| D. | 仅由非金属元素组成的物质不可能含有离子键 |
9.下列物质能使溴水溶液因发生化学反应而褪色的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
19.下列物质中,互为同分异构体的是( )
| A. | 淀粉和纤维素 | B. | 果糖和淀粉 | C. | 蔗糖和果糖 | D. | 果糖和葡萄糖 |
6.下列实验设计方案中,可行的是( )
| A. | 用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO42- | |
| C. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| D. | 先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
3.下列实验中,利用了盐酸的氧化性的是( )
| A. | 用盐酸除去铜粉中混有的铁粉 | |
| B. | 用浓盐酸和MnO2制氯气 | |
| C. | 用盐酸跟氢氧化钠溶液反应 | |
| D. | 盐酸和硝酸银溶液反应生成白色沉淀 |
4.某羧酸酯的分子式为C14H26O4,1mol该酯完全水解可得到1mol乙二酸和2mol某一元醇,则该一元醇的结构可能有(不考虑立体异构)( )
| A. | 15种 | B. | 16种 | C. | 17种 | D. | 18种 |