题目内容
16.大苏打(Na2S2O3•5H2O)、苏打、小苏打被称为“三苏”,它们在生活、生产中用途广泛.(1)工业上,将苏打和硫化钠以1:2的物质的量之比配成溶液,再通入SO2气体,可制得Na2S2O3,同时放出CO2.写出该反应的化学方程式2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.
硫化钠溶液在空气中久置,会生成淡黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式Na2S2.
(2)Na2S2O3标准液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因S2O32-+2H+=S↓+H2O+SO2↑.
(3)工业上用大苏打溶液吸收工业废气中的氯气,其氧化产物为SO42-,写出离子方程式S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
(4)工业上常用苏打和盐酸除去锅炉中水垢中的硫酸钙.先用饱和苏打溶液浸泡锅垢,然后用盐酸清洗.“浸泡”的目的是将CaSO4转化为CaCO3,CaSO4+CO32-=CaCO3+SO42-.(并用离子方程式表示)
(5)在密闭的容器中投入一定量的Na2O2和NaHCO3固体,在300℃下充分反应.若残留固体为纯净物,则起始时n(NaHCO3):n(Na2O2)满足的条件是≥2 .
分析 (1)依据题干可知Na2C03和Na2S以1:2的物质的量之比混合,再通入二氧化硫发生反应生成Na2S2O3和二氧化碳,依据原子个数守恒、得失电子守恒书写方程式;
依据过氧化钠结构结合氧原子、硫原子结构解答;
(2)酸性环境下S2O32-发生歧化反应,消耗的硫代硫酸根钠偏多,测定结果会偏高;
(3)工业上用大苏打溶液吸收工业废气中的氯气,其氧化产物为SO42-,离子反应方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(4)将硫酸钙转化为易除的碳酸钙;
(5)Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,残留固体为纯净物,则为碳酸钠,由此分析解答.
解答 解:(1)依据题干可知Na2C03和Na2S以1:2的物质的量之比混合,再通入二氧化硫发生反应生成Na2S2O3和二氧化碳,反应中S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,依据原子个数守恒、得失电子守恒反应的方程式:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;
Na2S溶液在空气中长期放置,和氧气反应生成与过氧化钠的结构及化学性质相似的物质Na2S2;
故答案为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;Na2S2;
(2)酸性环境下S2O32-发生歧化反应,离子方程式:S2O32-+2H+=S↓+H2O+SO2↑,故答案为:S2O32-+2H+=S↓+H2O+SO2↑;
(3)工业上用大苏打溶液吸收工业废气中的氯气,其氧化产物为SO42-,离子反应方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(4)将硫酸钙转化为易除的碳酸钙,离子反应方程式为:将CaSO4转化为CaCO3,CaSO4+CO32-=CaCO3+SO42-,故答案为:将CaSO4转化为CaCO3,CaSO4+CO32-=CaCO3+SO42-;
(5)Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,残留固体为纯净物,则为碳酸钠,则n(NaHCO3):n(Na2O2)≥2,故答案为:≥2.
点评 本题考查了氧化还原反应,侧重考查氧化还原反应方程式的书写,明确氧化还原反应得失电子守恒规律是解题关键,题目难度中等.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案| A. | ②③④① | B. | ④②③① | C. | ④③①② | D. | ②①③④ |
| A. | ①②③⑤ | B. | ④⑥ | C. | ①④⑥ | D. | ②③⑤ |
| 选项 | 现象或事实 | 解释 |
| A | 已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术 | 水热反应可以降低自然界中碳的含量 |
| B | 用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭.发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来 | 导致易拉罐又鼓起来的反应是: Al3++3HCO3-=Al(OH)3+3CO2↑ |
| C | FeCl3溶液可用于制作铜质印刷线路板的“烂板液” | FeCl3溶液能将铜氧化为Cu2+ |
| D | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 | 乙烯能够与高锰酸钾溶液发生加成反应,从而起到去除乙烯的目的 |
| A. | A | B. | B | C. | C | D. | D |
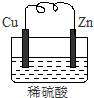 由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.
由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.