题目内容
下列关于化学反应类型的叙述中,正确的是( )
| A、凡是生成盐和水的反应都是中和反应 |
| B、氧化还原反应一定有单质参加 |
| C、生成一种单质和一种化合物的反应一定是置换反应 |
| D、生成物中有单质的分解反应一定属于氧化还原反应 |
考点:化学基本反应类型
专题:物质的性质和变化专题,元素及其化合物
分析:A、碱性氧化物与酸、酸性氧化物与碱反应均能生成盐和水;
B、根据氧化还原反应的概念来判断;
C、根据置换反应的定义来判断;
D、根据氧化还原反应的定义来判断.
B、根据氧化还原反应的概念来判断;
C、根据置换反应的定义来判断;
D、根据氧化还原反应的定义来判断.
解答:
解:A、碱性氧化物与酸、酸性氧化物与碱反应均能生成盐和水,故A错误;
B、氧化还原反应指的是有元素发生化合价变化的反应,不一定有单质参加,故B错误;
C、置换反应是一种单质和一种化合物生成另一种单质好另一种化合物的反应,故C错误;
D、当分解反应有单质生成时,一定有元素发生化合价的变化,故一定是氧化还原反应,故D正确.
故选D.
B、氧化还原反应指的是有元素发生化合价变化的反应,不一定有单质参加,故B错误;
C、置换反应是一种单质和一种化合物生成另一种单质好另一种化合物的反应,故C错误;
D、当分解反应有单质生成时,一定有元素发生化合价的变化,故一定是氧化还原反应,故D正确.
故选D.
点评:本题考查了四大基本反应类型与氧化还原反应的关系,掌握氧化还原反应指的是有元素发生化合价变化的反应是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学键的键能是指气态原子间形成1mol 化学键时释放的能量.如H(g)+Cl(g)═H-Cl(g)△H=-431kJ?mol-1,即H-Cl键的键能为431kJ?mol-1,也可以理解为破坏1mol H-Cl键需要吸收431kJ的能量.已知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,蒸发1mol H2O(l)需要吸收的能量为44kJ,其他相关数据如下表:则表中a为( )
| H-H | O═O | H-O | |
| 键能(kJ/mol) | 436.4 | a | 462.8 |
| A、185.2 |
| B、224.0 |
| C、518.8 |
| D、494.8 |
为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量.发生的化学反应为:4CuI+Hg=Cu2HgI4+2Cu.下列说法不正确的是( )
| A、上述反应属于置换反应 |
| B、该反应中的氧化剂与还原剂的物质的量之比为2:l |
| C、Cu2HgI4既是氧化产物又是还原产物 |
| D、当有1 mol CuI参与反应时,转移电子的物质的量为0.5 mol |
下列说法正确的是( )
| A、Ni的还原性比铁稍弱,可采用金属铝作还原剂的热还原法 |
| B、在新制的氯水中加入NaOH溶液至中性时,满足C(Na+)═C(ClO-)+C(HClO) |
| C、在某溶液中加入K3Fe(CN)6若产生蓝色沉淀即可证明Fe3+ 的存 |
| D、在相同温度下,向1mL 0.2mol?L-1 NaOH溶液中滴入2滴0.1 mol?L-1 MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol?L-1 FeCl3溶液,又生成红褐色沉淀,可证明Fe(OH)3的溶解度小于Mg(OH)2 |
如表为元素周期表中短周期的一部分,下列说法正确的是( )
| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
| A、①~⑥一定全部是非金属元素 |
| B、对应单质的活泼性:②>③ |
| C、④的最高价氧化物对应的水化物可能为两性物质 |
| D、②、⑤的最高价氧化物对应的水化物可能均为强酸 |
既能与盐酸反应,又能与氢氧化钠反应的有机物是( )
| A、CH3COOH |
| B、丙氨酸 |
| C、Al(OH)3 |
| D、NaHCO3 |
鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )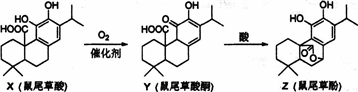

| A、X、Y、Z互为同系物 |
| B、X、Y、Z均能与FeCl3溶液发生显色反应 |
| C、1molZ与NaOH溶液反应最多消耗3molNaOH |
| D、1molY与浓溴水反应最多消耗3molBr2 |
设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A、100mL 3mol/L盐酸与5.6g Fe充分反应转移0.3NA个电子 |
| B、标准状况下,22.4L乙醇中含有的碳原子数目为2NA个 |
| C、16g O2和O3的混合物中含有的氧原子数目为NA个 |
| D、0.05mol熔融的CaCl2中含有0.1NA个阳离子 |
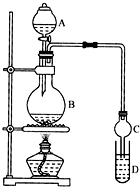 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下: