题目内容
17.CuSO4溶液对过氧化氢的分解有催化作用(2H2O2═2H2O+O2↑).取溶质质量分数为8.5%的过氧化氢溶液20g倒入小烧杯中,向其中加入溶质质量为0.75g的CuSO4溶液10.8g,使过氧化氢完全分解.试计算:(1)产生氧气的质量;
(2)反应后所得溶液中CuSO4的质量分数.
分析 (1)先计算H2O2的质量,然后代入2H2O2═2H2O+O2↑计算产生氧气的质量;
(2)反应后所得溶液的质量为20g-0.8g+10.8g,CuSO4的质量仍为0.75g,代入ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算.
解答 解:(1)20g质量分数为8.5%的过氧化氢溶液中含有H2O2的质量为20g×8.5%=1.7g,
设生成氧气的质量为x.
2H2O2═2H2O+O2↑
68 32
1.7g x
$\frac{68}{1.7g}=\frac{32}{x}$,x=0.8g,
答:产生氧气的质量为0.8g;
(2)反应后所得溶液的质量为20g-0.8g+10.8g=30g,CuSO4起催化作用,质量仍为0.75g,
反应后所得硫酸铜溶液的溶质质量分数ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%=$\frac{0.75g}{30g}$×100%=2.5%,
答:反应后所得溶液中CuSO4的质量分数为2.5%.
点评 本题考查化学方程式及溶液中溶质的质量分数的计算,题目难度中等,注意催化剂在反应前后质量和化学性质不变.

练习册系列答案
相关题目
12.为吸收多余的氯气,防止污染环境,下列试剂中最合适的是( )
| A. | 烧碱溶液 | B. | 饱和石灰水 | C. | 自来水 | D. | 食盐水 |
2.同分异构现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是( )
①CH2=CHCH3②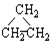 ③CH3CH2CH3 ④HC≡C-CH3.
③CH3CH2CH3 ④HC≡C-CH3.
①CH2=CHCH3②
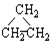 ③CH3CH2CH3 ④HC≡C-CH3.
③CH3CH2CH3 ④HC≡C-CH3.| A. | ①和② | B. | ①和③ | C. | ①和④ | D. | ②和④ |
9.某温度下,某碳酸钠饱和溶液质量分数为a%,;若分别向其中加入m molNa2CO3•5H2O和n mol Na2CO3,可析出相同质量的晶体Na2CO3•10H2O.则下列叙述正确的是( )
| A. | a可能是40,m>n | B. | a可能是40,m=n | C. | a可能是30,m>n | D. | a可能是30,m<n |
6.在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
| A. | 溶液中有晶体析出,Na+数目不变 | |
| B. | 溶液中的OH- 物质的量浓度不变,有O2放出 | |
| C. | 溶质的质量分数增大 | |
| D. | 溶液中NaOH的浓度减小,有O2放出 |
7.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1.8 g D2O中含有的质子数、中子数均为NA | |
| B. | 标准状况下,22.4 L CCl4含有NA个CCl4分子 | |
| C. | 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA |
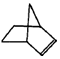
 可简写为
可简写为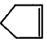 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: