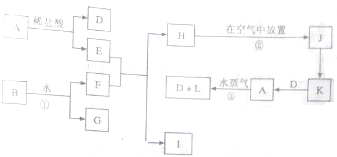
题目内容
在过量FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变为棕黄色.为检验上述反应中的还原产物,下列实验步骤中合理的组合是( )
①过滤,取滤液
②加入硝酸酸化的AgNO3溶液出现白色沉淀
③取一支试管,加入上述反应后的少许溶液
④再加入过量Ba(NO3)2溶液,出现白色沉淀
⑤再加入过量BaCl2,溶液,出现白色沉淀.
①过滤,取滤液
②加入硝酸酸化的AgNO3溶液出现白色沉淀
③取一支试管,加入上述反应后的少许溶液
④再加入过量Ba(NO3)2溶液,出现白色沉淀
⑤再加入过量BaCl2,溶液,出现白色沉淀.
| A、③⑤①② | B、③② |
| C、②③④⑤ | D、③④①② |
考点:常见阴离子的检验,常见阳离子的检验
专题:
分析:检验反应中的还原产物Cl-,需要用硝酸酸化的硝酸银溶液与待检测的溶液反应生成氯化银白色沉淀;而溶液中的硫酸根离子也可与银离子反应产生白色沉淀,故首先要排除硫酸根离子的干扰,而且除去硫酸根离子时,不能引入氯离子,据此进行解答.
解答:
解:在过量FeSO4溶液中滴入几滴NaClO溶液,二者发生氧化还原反应,还原产物为氯离子,检验氯离子时应该先用过量的Ba(NO3)2溶液除去硫酸根离子,然后过滤,再用硝酸酸化的硝酸银溶液检验氯离子,所以实验步骤为:③取一支试管,加入上述反应后的少许溶液、④再加入过量Ba(NO3)2溶液,出现白色沉淀、①过滤,取滤液、②加入硝酸酸化的AgNO3溶液出现白色沉淀,
故选D.
故选D.
点评:本题考查了常见离子的检验方法,题目难度中等,明确常见离子的化学性质及检验方法为解答关键,注意检验离子存在时,需要排除干扰离子,确保检验方案的严密性.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
相关题目
常温下,下列溶液中各组离子一定大量共存的是( )
| A、澄清透明的溶液中:K+、Al3+、SO42-、MnO4- |
| B、0.1mol?L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3- |
| C、滴入KSCN显血红色的溶液中:NH4+、Mg2+、S2-、Cl- |
| D、c(H+)=1×10-13 mol?L-1的溶液中:Na+、NH4+、SO42-、CO32- |
某一反应体系有反应物和生成物共五种物质:O2﹑H2CrO4﹑Cr(OH)3﹑H2O﹑H2O2.已知该反应中H2O2只发生如下过程:H2O2
O2下列说法正确的是( )
| 转化为 |
| A、O2和Cr(OH)3是反应物 |
| B、产物中一定有H2O |
| C、H2O2是氧化剂 |
| D、2 mol H2O2反应需要3 mol H2CrO4 |
下列溶液中有关物质的浓度关系正确的是( )
| A、c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl) |
| B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D、某二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-) |
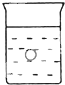 在一烧杯中盛有稀H2S04溶液.同时有一表面光滑的塑料小球悬浮于溶液中央,如图所示.向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应.在此实验过程中
在一烧杯中盛有稀H2S04溶液.同时有一表面光滑的塑料小球悬浮于溶液中央,如图所示.向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应.在此实验过程中