题目内容
6.根据下列叙述写出相应的热化学方程式:(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是S(s)+O2(g)=SO2(g),△H=-296.8 kJ/mol
(2)已知:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ•mol-1
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol.
(3)拆开1mol H-H键、1mol N-H键、1mol N≡N键需要的能量分别是436kJ、391kJ、946kJ,则1mol N2完全反应生成NH3的反应热为N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1,1mol H2完全反应生成NH3所放出的热量为30.7KJ.
分析 (1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,据此书写热化学方程式;
(2)已知:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ•mol-1
根据盖斯定律将方程式变形(3×①-②-2×③)÷6计算;
(3)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g),△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g),△H=-296.8 kJ/mol;
(2)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ•mol-1
根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1-△H2-2×△H3)÷6=-11KJ/mol.
故答案为:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol;
(3)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1,所以1mol H2完全反应生成NH3所放出的热量为$\frac{92}{3}$KJ=30.7KJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1;30.7KJ.
点评 本题考查了热化学反应方程式的书写,注意盖斯定律的应用和对应化学方程式焓变的计算等,题目较简单.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
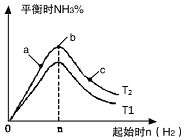 在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
| 乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
起始时乙中的压强是甲容器的0.8倍,乙的平衡常数为107(mol/L)-2
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是bc(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
①像中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是c(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为0.24mol.L-1.min-1.保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q>110.88kJ(填“>”、“<”或“=”).
| A. | 蛋白质在体内代谢的最终产物是硝酸 | |
| B. | 灼烧蛋白质没有明显现象 | |
| C. | 误食重金属盐会使人中毒,应立即喝牛奶、豆浆解毒 | |
| D. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 |
| A. | 盐的组成中不一定含有金属元素 | |
| B. | 强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 | |
| C. | 同种元素在不同的化合物中的化合价不一定相同 | |
| D. | 由同种元素组成的物质一定是单质 |
 )的官能团的名称为碳碳双键、羟基.
)的官能团的名称为碳碳双键、羟基.