题目内容
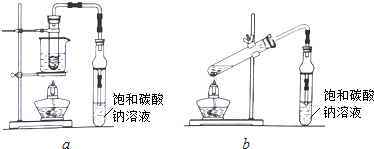
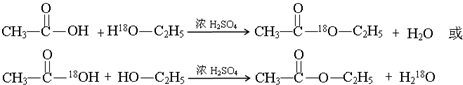
1.某课外实验小组设计的制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.请回答:(1)浓硫酸的作用是制醋酸、催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式
 ;
;(2)球形漏斗C的作用是防止倒吸兼冷凝.若反应前向D中加入几滴酚酞试液,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层无色油状液体,下层溶液颜色变浅..
分析 (1)浓硫酸具有酸性,能够与醋酸钠反应生成乙酸,乙酸、乙醇在浓硫酸做催化剂、吸水剂条件下反应生成乙酸乙酯,据此解答;
酯化反应原理为:酸去羟基、醇去氢,据此书写方程式;
(2)乙酸、乙醇易溶于碳酸钠溶液,会导致装置内气体减小,容易发生倒吸;碳酸钠为强碱弱酸盐,水解生成碳酸氢根离子和氢氧根离子;乙酸乙酯密度小于水,难溶于水,碳酸钠溶液显碱性,遇到酚酞变红;
解答 (1)浓硫酸具有酸性,能够与醋酸钠反应生成乙酸,可以用浓硫酸制备乙酸,乙酸、乙醇在浓硫酸做催化剂、吸水剂条件下反应生成乙酸乙酯;
酯化反应原理为:酸去羟基、醇去氢,乙酸与乙醇发生酯化反应的方程式: ;
;
故答案为:制醋酸、催化剂、吸水剂; ;
;
(2)乙酸、乙醇易溶于碳酸钠溶液,会导致装置内气体减小,容易发生倒吸,球形干燥管还可以防止倒吸,同时球形干燥管兼有冷凝蒸汽的作用;碳酸钠为强碱弱酸盐,水解生成碳酸氢根离子和氢氧根离子,离子方程式:CO32-+H2O?HCO3-+OH-;乙酸乙酯密度小于水,难溶于水,碳酸钠溶液显碱性,遇到酚酞变红,所以会看到现象为:溶液分层,上层无色油状液体,下层溶液颜色变浅;
故答案为:防止倒吸兼冷凝;CO32-+H2O?HCO3-+OH-;溶液分层,上层无色油状液体,下层溶液颜色变浅.
点评 本题考查了乙酸乙酯的制备,题目难度不大,涉及浓硫酸、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
相关题目
8.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,16g甲烷所含原子数为4NA | |
| B. | 标准状况下,2.24LCH4和NH3混合气气体中含有的电子数目为NA | |
| C. | 标准状况下,11.2L的HCl溶于1.0L的水中,所得溶液中HCl的浓度为0.5mol/L | |
| D. | 常温下,5.6克铁与足量的盐酸反应,失去的电子数为0.2mol |
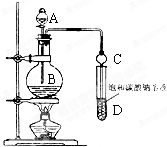
6. 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层、上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分液(填操作名称)后,除去乙醇和水;然后对液体混合物进行蒸馏,收集77.1℃左右的馏分,以得到较纯净的乙酸乙酯.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层、上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分液(填操作名称)后,除去乙醇和水;然后对液体混合物进行蒸馏,收集77.1℃左右的馏分,以得到较纯净的乙酸乙酯.
13.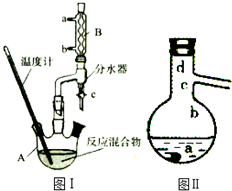 乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
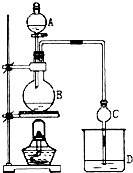
Ⅰ.将混合液(18.5mL正丁醇和13.4mL乙酸(过量),0.4mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟.
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤.
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1g乙酸正丁酯.
部分实验数据如表所示:
(1)仪器A的名称是三颈烧瓶使用分水器(实验中可分离出水)能提高酯的产率,其原因是不断分离出水,使容器内H2O浓度变小,有利于平衡向酯化反应方向移动
(2)步骤Ⅱ中的操作顺序为①③①②(填序号),用Na2CO3溶液洗涤的目的是除去残留在产品中的酸,试剂X不能选用下列物质中的b(填字母序号).
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示).
①蒸馏过程中需要使用直形冷凝管,当仪器连接好后,
a.向相应的冷凝管中通冷凝水;
b.加热蒸馏烧瓶的先后顺序是先a后b.(填“先a后b“或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的a、b(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质.
(4)该实验乙酸正丁酯的产率是74%(计算结果保留2位有效数字).
 乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:Ⅰ.将混合液(18.5mL正丁醇和13.4mL乙酸(过量),0.4mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟.
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤.
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1g乙酸正丁酯.
部分实验数据如表所示:
| 化合物 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 溶解度(g)/(100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 乙酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 1 1 6 | 0.882 | 126.1 | 0.7 |
(2)步骤Ⅱ中的操作顺序为①③①②(填序号),用Na2CO3溶液洗涤的目的是除去残留在产品中的酸,试剂X不能选用下列物质中的b(填字母序号).
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示).
①蒸馏过程中需要使用直形冷凝管,当仪器连接好后,
a.向相应的冷凝管中通冷凝水;
b.加热蒸馏烧瓶的先后顺序是先a后b.(填“先a后b“或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的a、b(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质.
(4)该实验乙酸正丁酯的产率是74%(计算结果保留2位有效数字).
10.实验室制备乙酸乙酯(CH3COOCH2CH3)时有如下副反应:
2CH3CH2OH$?_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
相关有机化合物的一些性质如下表:
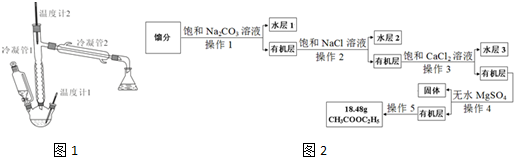
(CH3COOC2H5在饱和盐溶液中溶解度较小,C2H5OH能与CaCl2生成配合物)装置如图1所示(加热、支撑等装置略去).在三口瓶内先装入10mL95%乙醇与6mL浓硫酸混合液,并加入几粒沸石.在恒压滴液漏斗中加入15mL冰醋酸与15mL无水乙醇的混合液.加热,由恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近.保持反应液体温度在120-125℃,收集馏分.
(1)写出实验室制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{120-125℃}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)①加热三口瓶,最好的方法是C(填选项).
A.水浴 B.酒精灯 C.油浴 D.酒精喷灯
②若滴加液体速度太快会造成多种不利影响,其一是反应液体温度下降过快.
(3)产物提纯的流程如图2:
①操作1的名称是分液,操作5的名称是蒸馏.
②加入饱和Na2CO3溶液的目的是为了除去醋酸.
③加入饱和NaCl溶液是为了除去有机层中少量Na2CO3,其目的是防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗.
④加入饱和CaCl2溶液的目的是为了除去CH3CH2OH,加入无水MgSO4的目的是为了除去水.
⑤乙酸乙酯的产率是80%.
2CH3CH2OH$?_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
相关有机化合物的一些性质如下表:
| 分子式 | 相对分子 质量 | 熔点 /℃ | 沸点 /℃ | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | |||||
| CH3COOH | 60 | 16.6 | 117.9 | 1.05 | 互溶 | 互溶 | 互溶 |
| C2H5OH | 46 | -117.3 | 78.5 | 0.8 | 互溶 | / | 互溶 |
| CH3COOC2H5 | 88 | -83.58 | 77.1 | 0.9 | 可溶 | 互溶 | 互溶 |
| C2H5OC2H5 | 74 | -116.2 | 34.51 | 0.7 | 可溶 | 互溶 | / |

(1)写出实验室制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{120-125℃}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)①加热三口瓶,最好的方法是C(填选项).
A.水浴 B.酒精灯 C.油浴 D.酒精喷灯
②若滴加液体速度太快会造成多种不利影响,其一是反应液体温度下降过快.
(3)产物提纯的流程如图2:
①操作1的名称是分液,操作5的名称是蒸馏.
②加入饱和Na2CO3溶液的目的是为了除去醋酸.
③加入饱和NaCl溶液是为了除去有机层中少量Na2CO3,其目的是防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗.
④加入饱和CaCl2溶液的目的是为了除去CH3CH2OH,加入无水MgSO4的目的是为了除去水.
⑤乙酸乙酯的产率是80%.
 2NH3(g) ΔH<-38.6 kJ·mol-1
2NH3(g) ΔH<-38.6 kJ·mol-1