题目内容
高岭土中[Al2(Si2O5)(OH)4]中SiO2的质量分数为( )
| A、46.5% |
| B、23.3% |
| C、21.7% |
| D、35.7% |
考点:元素质量分数的计算,含硅矿物及材料的应用
专题:计算题
分析:Al2(Si2O5)(OH)4改写为氧化性形式为Al2O3?2SiO2?2H2O,SiO2的质量分数=(二氧化硅的总相对分子质量÷Al2O3?2SiO2?2H2O的相对分子质量)×100%.
解答:
解:Al2(Si2O5)(OH)4改写为氧化性形式为Al2O3?2SiO2?2H2O,
SiO2的质量分数=
×100%=46.5%,
故选A.
SiO2的质量分数=
| 2×(28+32) |
| 102+120+36 |
故选A.
点评:本题考查根据化学式进行质量分数的计算,关键是将硅酸盐改写成氧化物的形式,学生容易忽略改写,而根据Si守恒认为1molAl2(Si2O5)(OH)4含有2mol二氧化硅,导致错误结果.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 盐MN溶于水的过程如图所示:下列说法不正确的是( )
盐MN溶于水的过程如图所示:下列说法不正确的是( )| A、MN是强电解质 |
| B、N-结合H+的能力一定比OH-强 |
| C、该过程中c(OH-)>c(H+) |
| D、溶液中存在c(HN)=c(OH-)-c(H+) |
下列有关实验原理或操作不正确的是( )
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、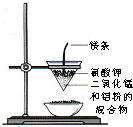 用如图装置制取少量金属锰 |
D、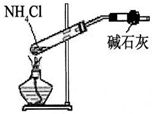 实验室用如图所示装置制取少量氨气 |
下列说法正确的是( )
| A、电解饱和食盐水时,溶液中的OH-向阴极移动 |
| B、需要加热才能发生的反应不一定是吸热反应 |
| C、短周期元素形成离子后,最外层都能达到8(或2)电子稳定结构 |
| D、金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |
下列反应的离子方程式书写正确的是( )
| A、大理石和盐酸的反应:CO32-+2H+=CO2↑+H2O | ||||
| B、向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ | ||||
| C、氯气与氢氧化钠溶液反应:Cl2+OH-=Cl-+HClO | ||||
D、电解饱和食盐水:2Cl-+2H2O
|
 FeCl3溶液与KSCN溶液混合,发生反应:Fe3+(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)△H.其中[Fe(SCN)]2+的浓度与温度T的关系如图所示.下列说法正确的是( )
FeCl3溶液与KSCN溶液混合,发生反应:Fe3+(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)△H.其中[Fe(SCN)]2+的浓度与温度T的关系如图所示.下列说法正确的是( )| A、△H>O |
| B、反应处于D点时,一定有v正<v逆 |
| C、溶液中c(Fe3+):A点>B点 |
| D、T1、T2时相应的平衡常数分别为K1、K2,则K1<K2 |
