题目内容
4.实验室常用热的NaOH溶液洗去试管壁上的硫黄,其反应为6NaOH+3S═2Na2S+Na2SO3+3H2O.在此反应中硫表现出的性质是( )| A. | 氧化性 | B. | 还原性 | ||
| C. | 既无氧化性又无还原性 | D. | 既有氧化性又有还原性 |
分析 3S+6NaOH═2Na2S+Na2SO3+3H2O中,S元素的化合价由0升高为+4价,S元素的化合价由0降低为-2价,以此来解答.
解答 解:反应中只有S元素的化合价变化,S元素化合价由0价分别变化为+4、-2价,则S既是氧化剂又是还原剂,既表现了氧化性又表现了还原性,故选D.
点评 本题考查氧化还原反应,为高考常见题型,侧重氧化还原反应基本概念的考查,把握氧化剂、还原剂的反应及化合价变化即可解答,题目难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
15.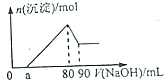 Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )
Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )
 Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )
Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )| A. | 若a=20mL时,则混合物中Fe2O3占0.02mol | |
| B. | 所滴加的Na0H溶液的浓度为4mol/L | |
| C. | a点处,Na0H溶液的体积为a<50mL | |
| D. | 若a=20mL,则剩余盐酸的体积为20mL |
19.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断试样的pH约为4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
则C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
ⅰ.若1L空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡正向(填“正向”或“逆向”或“不”下同)移动,逆反应速率变大(填“变大”或“变小”或“不变”).
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g).已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”)?
(4)综上所述,你对该市下一步的环境建设提出的建议是燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
则C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
ⅰ.若1L空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡正向(填“正向”或“逆向”或“不”下同)移动,逆反应速率变大(填“变大”或“变小”或“不变”).
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g).已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”)?
(4)综上所述,你对该市下一步的环境建设提出的建议是燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.
9.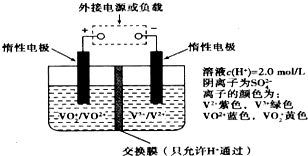 在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )
 在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )| A. | 充电过程中,H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应 | |
| B. | 放电过程中,右槽溶液中溶液颜色由紫色变为绿色 | |
| C. | 该电池为可逆电池,当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高 | |
| D. | 充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)增加了0.5mol |
16.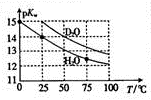 Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )
Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )
 Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )
Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )| A. | D20的电离过程为吸热过程 | B. | 25℃时,纯D20的pH等于7 | ||
| C. | 25℃时,pH=7的液体一定是纯H20 | D. | 常温下,向Dz0中加入DCI,pKw变大 |
14.有一种测定阿伏加德罗常数的方法需测定NaCl晶体的体积,具体步骤为:准确称出mg NaCl晶体粉末并置于定容仪器a中;用滴定管b向仪器a中滴加某液体c至a仪器的刻度线,即可测出NaCl固体的体积.上述步骤中的a、b、c分别指( )
| A. | 量筒、酸式滴定管、水 | B. | 容量瓶、碱式滴定管、苯 | ||
| C. | 量筒、碱式滴定管、水 | D. | 容量瓶、酸式滴定管、四氯化碳 |
 如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.