题目内容
5.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点.当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol•L-1)时,溶液中c(Ag+)为2.0×10-5 mol•L-1,此时溶液中c(CrO42-)等于5.0×10-3 mol•L-1.(已知Ag2 CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10).分析 当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,依据计算得到的银离子浓度和溶度积常数计算此时溶液中c(CrO42-)=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$.
解答 解:当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{2.0×1{0}^{-10}}{1.0×1{0}^{-5}}$=2.0×10-5mol/L
此时溶液中c(CrO42-)=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$=$\frac{2.0×1{0}^{-12}}{(2.0×1{0}^{-5})^{2}}$=5.0×10-3mol/L,
故答案为:2.0×10-5 ;5.0×10-3.
点评 本题难溶电解质的溶解,为高频考点,侧重考查学生的分析能力和计算能力,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
20.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A. | 原子半径:X>Y>W>Z | B. | 原子序数:Y>X>Z>W | ||
| C. | 原子最外层电子数:Y>X>Z>W | D. | 原子的电子层数:X=Y>W=Z |
13.甲、乙两种物质的溶解曲线如图所示.下列说法正确的是( )
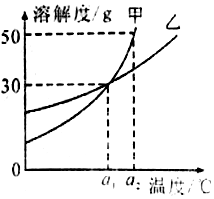

| A. | a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 | |
| B. | 甲和乙的溶解度相等 | |
| C. | a1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液 | |
| D. | a2℃时,在100g水中加入60g甲,形成不饱和溶液 |
20.Al、Fe、Cu都是重要的金属元素,下列说法正确的是( )
| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al | |
| D. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
10.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 22.4 L乙烷分子中的碳原子数目为2NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
14.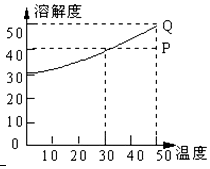 有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )
有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )
 有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )
有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )| A. | 50℃时,若该盐溶液含A克溶质,保持温度不变,加入A/4 g溶质,溶液必变成饱和溶液 | |
| B. | 50℃时,140g P点溶液最少需蒸发掉20g水才能形成饱和溶液 | |
| C. | 该溶液冷却至0℃时,析出溶质10 g | |
| D. | 在保持溶质及溶剂质量不变的情况下,使P点溶液达到饱和需降温20℃ |
15.对某难溶电解质AnBm的饱和溶液中,下列说法正确的是( )
| A. | 加水,它的溶度积减小、溶解度增大 | |
| B. | 升高温度,它的溶解度和溶度积都增大 | |
| C. | 饱和溶液中c(Am+)=c(Bn-) | |
| D. | 加水,它的溶度积、溶解度均不变 |