题目内容
2.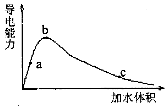 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的PH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的PH试纸上,测得PH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c |
分析 醋酸为弱电解,浓度越小,电离程度越大,对于该溶液,溶液的导电能力反映了氢离子的浓度,溶液导电能力越大,离子浓度越大,结合溶液的电荷守恒分析.
解答 解:A.醋酸为弱电解质,加水促进电离,浓度越小,电离程度越大,则乙酸的电离程度:a<b<c,故A错误;
B.电离程度反映了氢离子的浓度,溶液导电能力越大,离子浓度越大,氢离子浓度越大,pH越小,溶液的pH值:c>a>b,故B正确;
C、由图象可看出,a点稀释导电能力增强可能增强,也可能减弱,所以pH可能偏小也可能偏大,故C错误;
D、a、b、c三点溶液浓度不同,但溶质的物质的量相同,所以a、b、c三点溶液用同浓度的氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a=b=c,故D正确;
故选AC.
点评 本题考查弱电解质的电离,题目难度不大,注意把握弱电解质的电离特点,注意导电能力与离子浓度大小有关.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.关于过氧化尿素[CO(NH2)2•H2O2]的说法不正确的是( )
| A. | 组成元素都属于主族元素 | B. | 组成元素都属于非金属元素 | ||
| C. | 分子中只含有共价键 | D. | 分子中既含有共价键又含有离子键 |
10.相同质量的下列有机物在氧气中充分燃烧,生成CO2最多的是( )
| A. | C4H10 | B. | C6H6 | C. | C6H14 | D. | C8H10 |
17.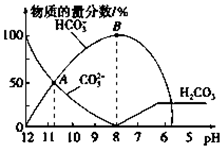 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| C. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| D. | 在0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
7.球墨铸铁中含有一种铁碳化合物X.实验室测定化合物X的组成实验如下:
化合物18.0g$→_{高温煅烧}^{足量空气}$固体1$\stackrel{过量盐酸}{→}$溶液甲$\stackrel{足量Cl_{2}}{→}$溶液乙$→_{灼烧}^{加热、蒸发}$固体24.0g
下列说法不正确的是( )
化合物18.0g$→_{高温煅烧}^{足量空气}$固体1$\stackrel{过量盐酸}{→}$溶液甲$\stackrel{足量Cl_{2}}{→}$溶液乙$→_{灼烧}^{加热、蒸发}$固体24.0g
下列说法不正确的是( )
| A. | 固体2是氧化铁 | |
| B. | X的化学式可以表示为Fe3C2 | |
| C. | 溶液甲中可能含有Fe3+ | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
14.将2aL Al2(SO4)3和(NH4)2SO4的混合物溶液分为两等份,其中一份加入b mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c mol NH3气,则原混合溶液中的Al3+离子浓度(mol/L)为( )
| A. | $\frac{2b-c}{a}$ | B. | $\frac{2b-c}{2a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6}$ |
11.下列说法正确的是( )
| A. | pH=6的降雨是酸雨 | |
| B. | 氯气泄漏后应顺风向低处跑 | |
| C. | SO2和HClO都具有漂白性,两者的漂白原理相同 | |
| D. | 我国城市环境中的大气污染物主要有SO2、NO2、可吸入颗粒物等 |