题目内容
10.下列说法正确的是( )| A. | 某反应正、逆反应的活化能分别为EakJ/mol、EbkJ/mol,则△H=-(Ea-Eb)kJ/mol | |
| B. | H2的热值为142.9kJ/g,则有2H2(g)+O2(g)═2H2O (1)△H=-285.8kJ/mol | |
| C. | 将浓度为0.1mol/LHF溶液加水不断稀释过程中,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持减小 | |
| D. | 混合前$\frac{c(C{H}_{3}COOH)}{c(NaOH)}$=2,等体积的混合后溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ |
分析 A.反应的焓变等于正、逆反应活化能之差;
B.根据氢气的热值计算出氢气的燃烧热,然后根据热化学方程式的书写原则写出该反应的热化学方程式;
C.将浓度为0.1mol/L HF溶液加水不断稀释过程中,加水稀释促进HF电离,温度不变,电离平衡常数不变,当接近中性时,氢离子浓度接近10-7 mol/L,氟离子浓度继续减小;
D.根据醋酸根离子的水解平衡常数来解答.
解答 解:A.某反应正、逆反应的活化能分别为EakJ/mol、EbkJ/mol,则△H=(Ea-Eb)kJ/mol,故A错误;
B.H2的热值为142.9kJ/g,则氢气的燃烧热为142.9×2kJ/mol=285.8kJ•mol-1,则燃烧的热化学方程式可表示为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,故B错误;
C.将浓度为0.1mol/L HF溶液加水不断稀释过程中,加水稀释促进HF电离,温度不变,电离平衡常数不变,当接近中性时,氢离子浓度接近10-7 mol/L,氟离子浓度继续减小,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持减小,故C正确;
D.混合前$\frac{c(C{H}_{3}COOH)}{c(NaOH)}$=2,等体积的混合后,溶液中存在等浓度的醋酸和醋酸钠,醋酸根离子的水解平衡常数K=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$,平衡常数K不等于氢离子浓度,故D错误;
故选C.
点评 本题考查反应热的计算、弱电解质的电离和盐类的水解,题目难度中等,充分考查了学生对所学知识的掌握情况,培养了学生灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.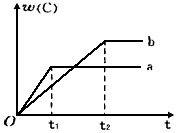 如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
 如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )| A. | 反应起始由逆反应开始建立平衡 | |
| B. | a表示有催化剂,b表示无催化剂 | |
| C. | 若n=2,其它条件相同,a比b的压强大 | |
| D. | 若其它条件相同,a比b的温度高 |
18.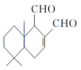 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )| A. | H2 | B. | Cu(OH)2悬浊液 | C. | HBr | D. | Br2的CCl4溶液 |
5.对下列实验事实的解释不正确的是( )
| 现 象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色物质且能溶于浓硝酸 |
| C | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法中,错误的是( )
| A. | 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| B. | 用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 | |
| C. | 无论乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关 | |
| D. | 乙烯的化学性质比乙烷的化学性质活泼 |
2.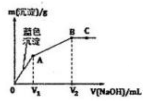 向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
 向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )| A. | 水的电离程度:A>B>C | |
| B. | 该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小 | |
| C. | 原溶液中MgCl2和CuCl2的物质的量浓度相等 | |
| D. | 若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成 |
6.下列有关推断中,不正确的是( )
| 事 实 | 结 论 | |
| A | CaCO3+2CH3COOH=(CH3COO)2Ca+CO2↑+H2O | 酸性:CH3COOH>H2CO3 |
| B | 氢硫酸(H2S)放置在空气中变浑浊 | 氧化性:O2>S |
| C | Al(OH)3既溶于强酸又溶于强碱 | Al元素既有金属性也有非金属性 |
| D | 反应A+2B?C达平衡后,升高温度平衡正向移动 | 升高温度,使v正增大、v逆减小 |
| A. | A | B. | B | C. | C | D. | D |
7.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 1 mol甲烷燃烧生成气态水和二氧化碳气体所放出的热量就是甲烷的燃烧热 | |
| C. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
 医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题: