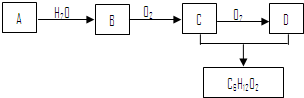
题目内容
12.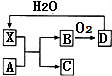 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A. | X使蔗糖变黑的现象主要体现了X的强氧化性 | |
| B. | 若A为铁,则A与X在室温下不会反应 | |
| C. | 若A为碳单质,则将C通入少量的澄清石灰水中,溶液仍然澄清 | |
| D. | 工业上在高温、常压和使用催化剂的条件下,可以使B完全转化为D |
分析 X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫,以此解答该题.
解答 解:X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫,
A.X使蔗糖变黑的现象主要体现了X的脱水性,故A错误;
B.若A是铁,常温下,铁与浓硫酸发生钝化现象,故B错误;
C.若A是碳,浓硫酸和碳反应生成二氧化碳、二氧化硫和水,二氧化碳和少量氢氧化钙反应生成可溶性的碳酸氢钙,故C正确;
D.二氧化硫转化为三氧化硫的反应为可逆反应,不能完全转化,故D错误;
故选C.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质,正确推断物质是解本题关键,本题的“题眼”是“x能使蔗糖粉末变黑”,以此来进行分析判断,难度中等.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
14.下列说法错误的是( )
| A. | 工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应 | |
| B. | 四川灾区重建使用了大量钢材,钢材是合金 | |
| C. | 金属材料都是导体,非金属材料都是绝缘体 | |
| D. | 合金材料中可能含有非金属元素 |
3.如图药品和装置合理且能完成相应实验的是( )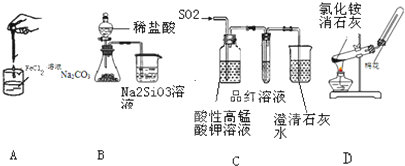

| A. | 制备氢氧化亚铁 | B. | 验证非金属性Cl>C>Si | ||
| C. | 检验二氧化硫中是否混有二氧化碳 | D. | 实验室制取并收集氨气 |
7.下列离子方程式书写正确的是( )
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | 将过量的SO2通入Ca(ClO)2溶液中:SO2+ClO-+H2O═HClO+HSO3- | |
| C. | 向MgSO4溶液中滴加Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
4.含有共价键的离子化合物是( )
| A. | HCl | B. | NaOH | C. | Na2O | D. | CH4 |
1.要将BaCl2、NaCl的混合溶液中分别得到纯净的BaCl2和NaCl晶体,在一系列的操作中应选用的试剂是( )
| A. | K2CO3稀盐酸 | B. | Na2CO3 稀盐酸 | C. | Na2CO3稀硫酸 | D. | NaOH 稀盐酸 |
2.图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )
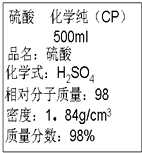

| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸25 mL | |
| C. | 该硫酸与等体积的水混合后所得溶液浓度为9.2 mol•L-1 | |
| D. | 该硫酸与等体积水混合后质量分数大于49% |

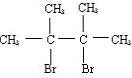
 .
.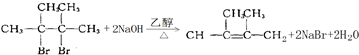 .
.