题目内容
依照阿伏加德罗定律,下列叙述不正确的是( )
| A、同温同压下,两种气体的体积之比等于物质的量之比 |
| B、同温同压下,两种气体的体积之比等于分子数之比 |
| C、同温同压下,两种气体的物质的量之比等于摩尔质量之比 |
| D、同温同体积下,两种气体的物质的量之比等于压强之比 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:同温同压下,气体摩尔体积相等,
A.根据V=nVm判断;
B.根据V=nVm、N=nNA判断;
C.根据n=
判断;
D.同温同体积时,压强与物质的量成正比.
A.根据V=nVm判断;
B.根据V=nVm、N=nNA判断;
C.根据n=
| m |
| M |
D.同温同体积时,压强与物质的量成正比.
解答:
解:同温同压下,气体摩尔体积相等,
A.该条件下,根据V=nVm知,两种气体的体积之比等于其物质的量之比,故A正确;
B.该条件下,根据V=nVm=
Vm知,两种气体的体积之比等于分子数之比,故B正确;
C.根据n=
知,如果质量相等时,两种气体的物质的量之比等于其摩尔质量反比,故C错误;
D.同温同体积时,压强与物质的量成正比,则两种气体的物质的量之比等于压强之比,故D正确;
故选C.
A.该条件下,根据V=nVm知,两种气体的体积之比等于其物质的量之比,故A正确;
B.该条件下,根据V=nVm=
| N |
| NA |
C.根据n=
| m |
| M |
D.同温同体积时,压强与物质的量成正比,则两种气体的物质的量之比等于压强之比,故D正确;
故选C.
点评:本题考查阿伏伽德罗定律及其推论,同时考查学生灵活运用知识解答问题能力,注意各个公式中各个物理量之间的关系,注意某些公式的适用范围及适用条件,题目难度不大.

练习册系列答案
相关题目
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol/L NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) |
| B、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(NH4+)=2c(SO42-) |
| C、将0.2mol/L CH3COOH溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH-)+c(CH3COO-)=c(H+)+c(Na+) |
| D、物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,c(NH4+)的大小关系:①>②>③ |
25℃时,amol/L稀盐酸与bmoL/L稀氢氧化钠溶液等体积混合后,所得溶液的pH=12(混合液的总体积可视为原两种溶液体积相加),则a和b的关系为( )
A、a=
| ||
| B、b=a+0.02 | ||
| C、a=b+0.02 | ||
| D、a=b+0.01 |
在2L的密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),有如下数据:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A、正反应为吸热反应 | ||
| B、实验1中,CO的转化率为80% | ||
C、650℃时,化学平衡常数K=
| ||
| D、实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol |
下列各组离子在溶液能大量共存,加入Fe2(SO4)3后仍能大量共存的是( )
| A、Na+I- CO32- ClO- |
| B、Fe2+ H+K+NO3- |
| C、Cu2+ Fe2+ Cl- NO3- |
| D、Ba2+Na+ SCN- Cl- |
下列反应:①Na+H2O②Na2O+H2O③NO2+H2O ④Cl2+H2O⑤F2+H2O⑥SO2+H2O中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是( )
| A、①③ | B、②⑥ | C、③④ | D、④⑤ |
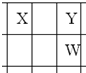 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )| A、五种元素中,原子半径最大的是W |
| B、Y的简单阴离子比W的简单阴离子还原性强 |
| C、Y与Z形成的化合物都可以和盐酸反应 |
| D、X与Q形成的化合物是离子化合物 |