题目内容
 已知25℃、101kPa下,如图所示,石墨的燃烧热为393.51kJ?mol-1,金刚石的燃烧热为395.41kJ?mol-1.下列说法或表达正确的是( )
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.51kJ?mol-1,金刚石的燃烧热为395.41kJ?mol-1.下列说法或表达正确的是( )| A、金刚石比石墨稳定 |
| B、△H1<△H2 |
| C、如果使用催化剂,△H1和△H2都变小 |
| D、C(s、石墨)=C(s、金刚石)△H=+1.9 kJ?mol-1 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:由图象可知石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)=CO2(g);△H=-393.51kJ.mol-1;C(金刚石)+O2(g)=CO2(g);△H=-395.41kJ.mol-1,二者相减可得C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol,以此解答该题.
解答:
解:由图象可知石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)=CO2(g);△H=-393.51kJ.mol-1;C(金刚石)+O2(g)=CO2(g);△H=-395.41kJ.mol-1,二者相减可得C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol,
A、金刚石燃烧放出能量较多,则说明金刚石总能量较大,石墨比金刚石稳定,故A错误;
B、应反应放热,则△H<0,金刚石放出的热量多,则有△H1>△H2,故B错误;
C、催化剂不改变反应热的大小,故C错误;
D、由以上分析可知C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol,故D正确;
故选D.
A、金刚石燃烧放出能量较多,则说明金刚石总能量较大,石墨比金刚石稳定,故A错误;
B、应反应放热,则△H<0,金刚石放出的热量多,则有△H1>△H2,故B错误;
C、催化剂不改变反应热的大小,故C错误;
D、由以上分析可知C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol,故D正确;
故选D.
点评:本题考查反应热,侧重于金刚石和石墨的转化,题目难度不大,注意对图象的分析.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
有两种气态饱和烃的混合物1L,完全燃烧可得同温同压下的3.6L二氧化碳和3.6L水蒸气,这两种烃可能是( )
| A、C2H4、C4H6 |
| B、C2H4、C4H8 |
| C、C3H8、C4H8 |
| D、C3H4、C3H6 |
下列各组离子在溶液能大量共存,加入Fe2(SO4)3后仍能大量共存的是( )
| A、Na+I- CO32- ClO- |
| B、Fe2+ H+K+NO3- |
| C、Cu2+ Fe2+ Cl- NO3- |
| D、Ba2+Na+ SCN- Cl- |
某温下,重水(D2O)的离子积为1.6×10-15,若用pH一样地定义pD,则该温下关于pD叙述正确的是( )
| A、纯重水中pD=7 |
| B、1L溶有0.01molNaOD的D2O溶液中,溶液的pD=12 |
| C、1L溶有0.01molDCl的D2O溶液中,溶液的pD=2 |
| D、在100mL0.25mol/LNaOD的重水中,加入50mL0.2mol/L的DCl的重水溶液,其pD=1 |
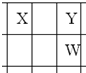 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )| A、五种元素中,原子半径最大的是W |
| B、Y的简单阴离子比W的简单阴离子还原性强 |
| C、Y与Z形成的化合物都可以和盐酸反应 |
| D、X与Q形成的化合物是离子化合物 |
在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g)?2c(g)△H<0,x(g)+3y(g)?2z(g)△H>0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述正确的是( )
| A、恒容时,通入x气体,y的物质的量浓度增大 |
| B、恒容时,通入x气体,反应器中温度升高 |
| C、恒容时,通入惰性气体,各反应速率不变 |
| D、恒压时,通入惰性气体,c的物质的量不变 |
下列有关结构和性质的说法中,正确的是( )
| A、元素非金属性Cl>S的实验依据是酸性HClO4>H2SO3 |
| B、碳元素的电负性小于氧元素,每个CO2分子中有4个σ键 |
| C、同周期主族元素的原子形成的简单离子的电子层结构一定相同 |
| D、Na、Mg、Al三种元素,其第一电离能由大到小的顺序为Mg>Al>Na |
节能减排对发展经济,保护环境有重要意义.下列措施不能减少二氧化碳排放的是( )
| A、利用太阳能制氢 |
| B、推广使用煤液化技术 |
| C、举行“地球一小时”熄灯活动 |
| D、关停小火电企业 |