题目内容
8.2015年8月12日23:30左右,天津滨海新区某公司仓库发生爆炸,事发仓库里存放了大量的硝酸铵、氰化钠(NaCN)、电石(CaC2)和金属钠等危险化学品.下列有关叙述正确的是(1)钠在周期表中的位置是第三周期第IA族,实验室少量的钠保存于煤油中.
(2)CaC2的电子式是
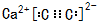 .
.(3)电石和金属钠都属于危化品中的易燃固体,其着火时不能用水灭火,请用化学方程式和必要的文字解释其原因:2Na+2H2O=2NaOH+H2↑、CaC2+2H2O=Ca(OH)2+C2H2↑,电石和金属钠都易与水反应生成可燃性气体,且放出大量热.
(4)氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡.氰化钠易溶于水,水溶液呈强碱性.氰化钠泄露可用双氧水或硫代硫酸钠中和.
①用离子方程式表示氰化钠水溶液呈强碱性的原因:CN-+H2O?HCN+OH-.
②用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式NaCN+H2O2+H2O═NaHCO3+NH3;
③用硫代硫酸钠中和的离子方程式为CN-+S2O32-→A+SO32-,A为SCN-(填化学式).
④在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3.
(5)CN-中C元素显+2价,N元素显-3价,则非金属性N>C(填<、=或>),请用简单的实验方法证明(要求说明简单操作、现象和结论):取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C.
分析 (1)钠在周期表中的位置是第三周期第IA族,钠易与水和氧气反应,所以要隔绝空气、水保存;
(2)CaC2是离子化合物,存在离子键和共价键;
(3)电石和金属钠都易与水反应生成可燃性气体,且放出大量热;
(4)①NaCN是强碱弱酸盐,氢氰根离子水解而使其水溶液呈碱性;
②用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,说明二者反应生成氨气、和碳酸氢钠;
③用硫代硫酸钠中和的离子方程式为CN-+S2O32-→A+SO32-,根据元素守恒、转移电子守恒判断产物;
④根据信息:CN-能够被氧气氧化成HCO3-,同时生成NH3来书写方程式;
(5)非金属性强的元素显示负价,非金属性弱的则显示正价;非金属的非金属越强,其最高价氧化物的水化物酸性越强.
解答 解:(1)钠在周期表中的位置是第三周期第IA族,钠易与水和氧气反应,所以要隔绝空气、水保存,
煤油和钠不反应且密度小于钠,所以钠可保存在煤油中,故答案为:第三周期第IA族;煤油;
(2)CaC2是离子化合物,存在离子键和共价键,其电子式为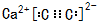 ,故答案为:
,故答案为: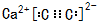 ;
;
(3)电石和金属钠都易与水反应生成可燃性气体,且放出大量热,2Na+2H2O=2NaOH+H2↑、CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:2Na+2H2O=2NaOH+H2↑、CaC2+2H2O=Ca(OH)2+C2H2↑,电石和金属钠都易与水反应生成可燃性气体,且放出大量热;
(4)①氰化钠为强碱弱酸盐,水解反应为:CN-+H2O?HCN+OH-,溶液呈碱性,
故答案为:CN-+H2O?HCN+OH-;
②用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O═NaHCO3+NH3↑,
故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
③CN-+S2O32-═A+SO32-,根据电荷守恒,A为-1价的阴离子,根据原子守恒,A中含有1个硫原子、1个碳原子、1个氮原子,所以A为:SCN-,
故答案为:SCN-;
④CN-能够被氧气氧化成HCO3-,同时生成NH3得出方程式为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3,
故答案为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3;
(5)CN-中C元素显+2价,N元素显-3价,说明N非金属性强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,其检验方法为:取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C;
故答案为:>;取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C.
点评 本题考查较综合,涉及非金属性强弱判断、氧化还原反应、盐类水解等知识点,为高频考点,明确物质性质、元素周期律、氧化还原反应基本原理等知识点即可解答,题目难度不大.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案(1)如表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
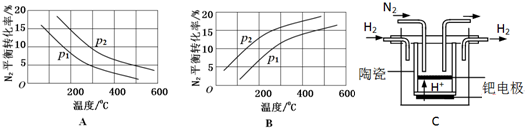
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
| A. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 若c(CH3COOH)=0.2mol/L,反应后的溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| D. | 若反应后的溶液呈中性,则:c(CH3COOH)+c(CH3COO-)>0.05mol/L |
| A. | 5 | B. | 9 | C. | 7 | D. | 14 |
| A. | Na2CO3、BaCl2 | B. | HCl、KNO3 | C. | HCl、Na2CO3 | D. | Na2CO3、KNO3 |
| A. | 氮气  | B. | 氯化氢  | C. | 氨气  | D. | 氯化镁 |
| A. | 2mol A+1mol B | |
| B. | 1mol C+1mol D | |
| C. | 2mol C+2mol D | |
| D. | 0.5mol A+0.5mol B+0.5mol C+1mol D |
| A. | AlCl3 | B. | Na2CO3 | C. | Na2SO3 | D. | MgSO4 |