题目内容
3.某无色溶液中,含有KNO3、BaCl2、Na2CO3、HCl中的两种溶质.向混合溶液中加入稀硫酸,只产生无色、无味气体的现象,则此溶液中所含的物质是( )| A. | Na2CO3、BaCl2 | B. | HCl、KNO3 | C. | HCl、Na2CO3 | D. | Na2CO3、KNO3 |
分析 加入稀硫酸只产生无色、无味的气体可推出,溶液中一定有Na2CO3,没有BaCl2,由于是混合溶液,Na2CO3存在,就不可能有HCl存在,因为二者要发生反应,不能共存于一个体系中,以此解答该题.
解答 解:四种物质中能和稀硫酸反应生成气体的只有Na2CO3,而BaCl2、HCl都能和Na2CO3发生反应生成沉淀或气体,不能共存于一个溶液中,所以BaCl2、HCl一定不能存在.
又由于题干告诉该无色溶液有两种溶质组成,所以也必须有KNO3存在,而且也可以和Na2CO3共存.
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质为解答该类题目的关键,难度不大.

练习册系列答案
相关题目
3.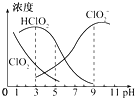 亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )
亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )
 亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )
亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )| A. | 25℃时HClO2的电离平衡常数Ka=10-6 | |
| B. | 使用漂白剂的最佳pH为3 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合混合溶液中c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) | |
| D. | 25℃时 用0.1000mol/LNaOH溶液滴定20.00ml某未知浓度的HClO2溶液 当滴入NaOH溶液体积为20.00ml时溶液呈中性 则HClO2溶液的实际浓度为0.11mol/L |
4.在盛放过氧化钠的试剂瓶的标签上应印有下列警示标记中的( )
| A. | 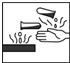 | B. |  | C. |  | D. |  |
1.以下条件最有利于反应的自发进行的是( )
| A. | △S>0,△H>0 | B. | △S<0,△H<0 | C. | △S<0,△H>0 | D. | △S>0,△H<0 |
8.下列平衡常数中,其中是表示水的离子积常数的是( )
| A. | K | B. | Ka | C. | Kb | D. | Kw |
 .
.