题目内容
 A是自然界存在最广泛的第ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由图表示:
A是自然界存在最广泛的第ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由图表示:请回答下列问题:
(1)E与水反应的化学方程式为
(2)G的电子式分别为
(3)D与H反应可能生成的盐有
(4)实际生产中,可由F为原料制备单质A,简述一种制备方法
考点:无机物的推断
专题:推断题
分析:A是自然界存在最广泛的第ⅡA族元素,常以化合物F存在.由图可知,F高温下分解生成D和G,则A为Ca,F为CaCO3,C为Ca(OH)2,D为CO2,G为CaO,B为氢气,E为NaH,H为NaOH,以此来解答.
解答:
解:A是自然界存在最广泛的第ⅡA族元素,常以化合物F存在.由图可知,F高温下分解生成D和G,则A为Ca,F为CaCO3,C为Ca(OH)2,D为CO2,G为CaO,B为氢气,E为NaH,H为NaOH,
(1)E与水反应的化学方程式为NaH+H2O═NaOH+H2↑,故答案为:NaH+H2O═NaOH+H2↑;
(2)G为CaO,为离子化合物,其电子式为Ca2+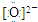 ,故答案为:Ca2+
,故答案为:Ca2+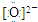 ;
;
(3)D为CO2,H为NaOH,D与H反应可能生成的盐有正盐和酸式盐,分别为Na2CO3、NaHCO3,故答案为:Na2CO3、NaHCO3;
(4)由F为原料制备单质A,方法为将CaCO3与盐酸反应转化为CaCl2,然后电解熔融的CaCl2固体就可以制得单质钙,
故答案为:将CaCO3与盐酸反应转化为CaCl2,然后电解熔融的CaCl2固体就可以制得单质钙.
(1)E与水反应的化学方程式为NaH+H2O═NaOH+H2↑,故答案为:NaH+H2O═NaOH+H2↑;
(2)G为CaO,为离子化合物,其电子式为Ca2+
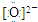 ,故答案为:Ca2+
,故答案为:Ca2+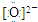 ;
; (3)D为CO2,H为NaOH,D与H反应可能生成的盐有正盐和酸式盐,分别为Na2CO3、NaHCO3,故答案为:Na2CO3、NaHCO3;
(4)由F为原料制备单质A,方法为将CaCO3与盐酸反应转化为CaCl2,然后电解熔融的CaCl2固体就可以制得单质钙,
故答案为:将CaCO3与盐酸反应转化为CaCl2,然后电解熔融的CaCl2固体就可以制得单质钙.
点评:本题考查无机物的推断,为高频考点,把握A、F为推断的突破口,侧重Na、Ca及其化合物转化的考查,把握发生的反应为解答的关键,电解法制备Ca为解答的难点,题目难度中等.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.图为RFC工作原理示意图,有关说法正确的是( )


| A、当有0.1mol电子转移时,a极产生1.12L O2(标准状况下) |
| B、b极上发生的电极反应是:4H2O+4e-═2H2↑+4OH- |
| C、c极上发生的电极反应是:O2+4H++4e-═2H2O |
| D、d极上进行还原反应,B中的H+可以通过隔膜进入A |
 如图是超导化合物--钙钛矿晶体的晶胞结构.请回答:
如图是超导化合物--钙钛矿晶体的晶胞结构.请回答: 用如图所示的装置进行电解.A中盛有足量CuSO4溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.A中盛有足量CuSO4溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的d区,且原子序数是d区中最大的.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的d区,且原子序数是d区中最大的.
