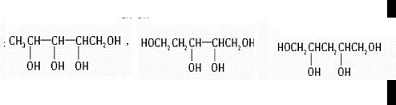
题目内容
18.下列有关电解质溶液中的粒子浓度关系正确的是( )| A. | 常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| B. | 0.1mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1pH=4的NaHC2O4溶液:c(H2C2O4)>c(C2O42-) | |
| D. | 向1.0L0.1mol•L-1的醋酸钠溶液中加入1.0L0.1mol•L-1盐酸:c(Na+)>c(CH3COO-)>c(H+) |
分析 A.根据电荷守恒和物料守恒分析;
B.NH4Cl溶液中铵根离子水解溶液显酸性;
C.溶液显酸性,说明HC2O4-的电离程度大于水解程度;
D.向1.0L0.1mol•L-1的醋酸钠溶液中加入1.0L0.1mol•L-1盐酸,反应生成醋酸和氯化钠,醋酸部分电离.
解答 解:A.常温下,pH=6的NaHSO3溶液中,电荷守恒为c(H+)+c(Na+)=c(OH-)+2c(SO32-)+c(HSO3-),物料守恒为c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),由两个守恒关系式消去钠离子的浓度可得,c(SO32-)-c(H2SO3)=c(H+)-c(OH-)=9.9×10-7mol•L-1,故A正确;
B.NH4Cl溶液中铵根离子水解溶液显酸性,所以c(H+)>c(OH-),则溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.0.1mol•L-1pH=4的NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度,所以c(C2O42-)>c(H2C2O4),故C错误;
D.向1.0L0.1mol•L-1的醋酸钠溶液中加入1.0L0.1mol•L-1盐酸,反应生成醋酸和氯化钠,醋酸部分电离,醋酸的浓度会减小,所以c(Na+)>c(CH3COO-)>c(H+),故D正确.
故选AD.
点评 本题考查了盐的水解、酸碱混合的定性判断及溶液pH计算、离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解原理判断离子浓度大小,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.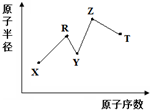 现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( )| A. | 离子半径:Y<Z | |
| B. | 氢化物的沸点:Y<T | |
| C. | 最高价氧化物对应水化物的酸性:T<R | |
| D. | 由X、Y、Z、R四种元素组成的常见化合物中含有离子键 |
6.A和B是前三周期的两种元素,他们的离子A2-和B3+具有相同的核外电子层结构,下列说法正确的是( )
| A. | 原子半径A>B | B. | 原子序数B>A | ||
| C. | 质子数A>B | D. | 元素所在的周期序数A>B |
3.下列有关物质用途的说法中,正确的是( )
| A. | 小苏打常用于配制波尔多液 | B. | 氮气、氨和干冰常用作制冷剂 | ||
| C. | Fe3O4常用作红色油漆和涂料 | D. | Na2O常用作呼吸面具中氧气的来源 |
10.下列说法正确的是( )
| A. | 糖类、油脂、蛋白质、乙酸都能发生水解反应 | |
| B. | 糖类、油脂、蛋白质都是只由C、H、0三种元素组成的 | |
| C. | 糖类、油脂、蛋白质都是天然高分子化合物 | |
| D. | 油脂有油和脂肪之分,但都属于酯 |
18.2016年1月《自然》杂志刊发了中科大科研组研究出一种新型电催化材料使CO2高效清洁地转化为液体燃料HCOOH.则下列说法不正确的是( )
| A. | 将CO2转化为燃料可减少CO2温室气体的排放 | |
| B. | CO2转化为HCOOH过程是CO2被还原的过程 | |
| C. | 新型电催化材料降低了CO2催化还原的活化能 | |
| D. | 新型电催化材料提高了CO2还原为HCOOH的平衡常数 |
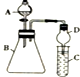 某同学利用如图装置探究同主族元素非金属性的变化规律.
某同学利用如图装置探究同主族元素非金属性的变化规律.